题目内容
【题目】硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺.以硫酸工业产生的二氧化硫尾气、氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质.合成路线如下:
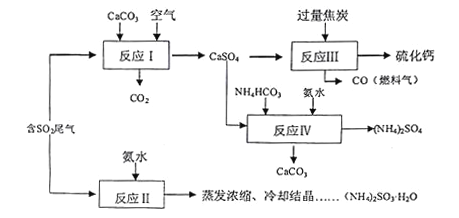
(1)写出反应Ⅰ的化学方程式________________________.
(2)反应Ⅲ中每生成lmol硫化钙理论上转移电子数________;为充分利用副产品CO,有人提出以熔融的K2C03为电解质,设计燃料电池,请写出此电池的负极反应_____________.
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有__________________.
(4)根据合成流程,可以循环利用的是____________.
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的离子方程式___________________.
【答案】2CaCO3+O2+2SO2=2CaSO4+2CO2 8NA CO+CO32﹣﹣2e﹣=2CO2 稀盐酸、BaCl2溶液 CaCO3 2NO2+4SO32﹣=N2+4SO42﹣
【解析】
本题是化学工艺流程题。以工业上处理二氧化硫的工艺(钙基固硫和氨水吸收)为主线生产相关产品,变废为宝。
(1). 钙基固硫的反应。因为亚硫酸酸性比碳酸强,所以将向碳酸钙浆液中通入二氧化硫可以生成亚硫酸钙和二氧化碳,亚硫酸钙再被氧气氧化为硫酸钙,总反应为:2CaCO3+O2+2SO2=2CaSO4+2CO2
(2). 反应Ⅲ的化学方程式为:CaSO4+4C = CaS+4CO↑,反应中硫的化合价从+6降到-2,共转移8个电子,所以每生成1molCaS理论上要转移的电子数为 8NA 。
(3). 根据CO的燃烧生成CO2,CO发发生了氧化反应,根据原电池原理,负极上还原剂发生氧化反应,由于电解质为熔融的碳酸钾,所以由提供氧原子与CO形成CO2分子,CO中C的化合价从+2升高到+4,要失去2个电子,所以电极反应式为:CO+CO32﹣﹣2e﹣=2CO2
(4). 反应Ⅱ得到的产品为亚硫酸铵易被空气中的氧气氧化生成硫酸铵,所以要检验产品是否变质可以检验硫酸根离子,实验室检验硫酸根离子的常用试剂为稀盐酸和BaCl2溶液
(5). 分析上述流程图可发现,反应I用到原料中有CaCO3 ,反应IV有副产品CaCO3生成,所以CaCO3可以循环利用。
(6). 二氧化氮有很强的氧化性,而亚硫酸根有很强的还原性,根据化合价通常邻位转化规律,二氧化氮可以将亚硫酸根氧化为硫酸根,所以离子方程式为:2NO2+4SO32﹣=N2+4SO42﹣