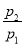题目内容
碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
①反应Ⅰ生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21∶127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为____________________。
②操作A包括__________________;用冰水洗涤的目的是__________________。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是_____________________________
②若制得1 284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水________ kg。
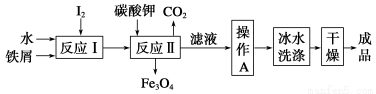
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为____________。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比________(选填“增大”、“减小”或“不变”)。
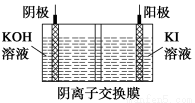
(1)①Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑
②蒸发浓缩、冷却结晶、过滤 洗涤除去表面可溶性杂质的同时减少KI的溶解损失
(2)①在较高温度下KIO3易分解 ②1 700
③I-+3H2O IO3—+3H2↑ 不变
IO3—+3H2↑ 不变
【解析】(1)①中n(Fe)/n(I)=3/8,该化合物为Fe3I8,和K2CO3反应的化学方程式为Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑(用质量守恒法配平,可假设Fe3I8的系数为1)
②操作A为了结晶出KI,所以应采取蒸发浓缩、冷却结晶,过滤的方法。因为温度高时,KI会溶解,所以应用冰水洗涤沉淀。
(2)①KIO3高温时会分解,所以加碘盐常在出锅前加入。
②根据电子守恒得:
x·2=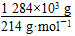 ×5
×5
x=15×103 mol
需要30% H2O2的质量为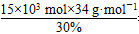 =1.7×106 g,即1 700 kg。
=1.7×106 g,即1 700 kg。
③电解时,阴极反应式为6H2O+6e-=3H2↑+6OH-,
阳极反应式为I--6e-+6OH-=IO3—+3H2O,
两式相加得:
I-+3H2O IO3—+3H2↑。
IO3—+3H2↑。
由于在阴极区生成的OH-通过阴离子交换膜移到阳极区,所以电解结束后阴极区的pH与电解前相比不变。