��Ŀ����
����Ŀ�������仯�����ڹ�ũҵ�������������������Ҫ���á�
(1)������һ����Ҫ�Ļ���ԭ�ϣ���̬�����dz��õķ��ϡ�
�������ϳɰ���������ط�ӦΪ:N2(g)+3H2(g)![]() 2NH3(g) ��H=-93kJ/mol��ʵ�������У����ù���������Fe�������������¶�773K��ѹǿ3.0��107Pa��ԭ������N2��H2���ʵ���֮��Ϊ1��2.8��
2NH3(g) ��H=-93kJ/mol��ʵ�������У����ù���������Fe�������������¶�773K��ѹǿ3.0��107Pa��ԭ������N2��H2���ʵ���֮��Ϊ1��2.8��
�ٺϳɰ������ǵ��Ĺ̶���һ�֣�����______(ѡ���������̵�����������̵������˹��̵���)��
�ںϳɰ���Ӧ��������ý���������й��ڴ�����˵������ȷ����_________��
A.���Լӿ췴Ӧ���� B.���Ըı䷴Ӧ��
C.���Լ��ٷ�Ӧ�е��ܺ� D.�������ӻ���ӵ���Ŀ
�۹��ںϳɰ����յ��������⣬��ȷ����_________��
A.ԭ������N2����������N2����ã��ʶȹ������������H2��ת����
B.�����¶�(773K)Զ�������£���Ϊ�˱�֤�����ܸߵ�ƽ��ת���ʺͿ�ķ�Ӧ����
C.���¶ȡ�ѹǿһ��ʱ����ԭ����(N2��H2�ı�������)�����������������壬���������ƽ��ת����
D.��������ɵ�N2��ͨ����Ȼ����ˮ����ת���ɵ�H2��ԭ�����뾭�������������Է�ֹ�����ж��Ͱ�ȫ�¹ʷ���
(2)��(N2H4)�ǵ����⻯��֮һ�����Ʊ��������ô����������������İ�����
�ٴ���������Һ�Լ��ԣ���ʾԭ�������ӷ���ʽ��_________________________��
�ڳ����£���ˮ�ⷴӦ��ƽ�ⳣ��ΪK=1.0��10-6mol/L����1.0mol/LNaClO��Һ��pH=____��
������N2O4������Ӧ����N2��ˮ������
��֪��N2(g)+2O2(g)=N2O4(l) ��H=-19.5kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) ��H=-534.2kJ/mol
��д���º�N2O4��Ӧ���Ȼ�ѧ��Ӧ����ʽ_________________________________��
(3)��NH4HCO3��Һ�У���ӦNH4++HCO3-+H2O![]() NH3��H2O+H2CO3��ƽ�ⳣ��K=_____��(��֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5��H2CO3�ĵ���ƽ�ⳣ��Ka1=4��10-7)��
NH3��H2O+H2CO3��ƽ�ⳣ��K=_____��(��֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5��H2CO3�ĵ���ƽ�ⳣ��Ka1=4��10-7)��
���𰸡��˹��̵� BC AD ClO-+H2O![]() HClO+OH- 11 2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ��H=-1048.9kJ/mol 1.25��103
HClO+OH- 11 2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ��H=-1048.9kJ/mol 1.25��103
��������
(1)���ɵ�Ԫ�صĵ��ʱ�Ϊ���Ļ�����Ĺ���Ϊ���Ĺ̶����ɸ��ݵ��̶���ʽ�жϹ̶���ʽ��
�ڴ����ɽ��ͷ�Ӧ�Ļ�ܣ������Ӱٷ������ӿ컯ѧ��Ӧ���ʵ�����ʹ��Ӧƽ�ⷢ���ƶ���
�۸��ݺϳɰ����ķ�Ӧ�����������С�ķ��ȷ�Ӧ���ӻ�ѧ��Ӧ���ʺͻ�ѧƽ���ƶ��Ƕȷ�����������Ժϳɰ�����Ӧ��Ӱ�죻
(2)�ٸ��ݴ���������ǿ�������Σ������ε�ˮ����ɷ�����
�ڸ���ˮ��ƽ�ⳣ���ĺ��������Һ��c(OH-)��Ȼ������ˮ�����ӻ�����c(H+)�ٸ���pH=-lg(H+)����pH��
�۸��ݸ�˹���ɣ��������Ȼ�ѧ����ʽ���ӣ��ɵ���Ӧ���Ȼ�ѧ����ʽ��
(3)����ˮ��ƽ�ⳣ���ı���ʽ��Kb��Ka1��ˮ�����ӻ��Ĺ�ϵ���㡣
(1)��N2��H2�ڴ�������ʱ���ڸ��¡���ѹ�����·�����Ӧ����NH3���÷�Ӧ���ڵ��Ĺ̶������˹��̵���
��A.����ý�Ǻϳɰ����Ĵ��������ڽ����˷�Ӧ�Ļ�ܣ�ʹ����ķ��ӱ�Ϊ����ӣ�����������ӣ���Ӧ���ʼӿ죬A��ȷ��
B.�������Ըı䷴Ӧ;���������ܸı����ʵ�ʼ̬����̬����˲����Ըı䷴Ӧ�ȣ�B����
C.���ڴ������ܸı����ʵ�ʼ̬����̬����˲��ܸı䷴Ӧ���̵������仯�����Բ��ܼ��ٷ�Ӧ�е��ܺģ�C����
D.���ڴ����ɽ��ͷ�Ӧ�Ļ�ܣ�ʹ�������ͨ���ӱ�Ϊ����ӣ����Կ������ӻ���ӵ���Ŀ��D��ȷ��
�ʺ���ѡ����BC��
��A.�ϳɰ�����N2��H2��Ӧ�����ʵ����ı���1��3�������ԭ������N2��H2���ʵ���֮��Ϊ1��2.8��N2����������N2����ã��ʶȹ������Լӿ췴Ӧ���ʣ�����������һ�ַ�Ӧ���Ũ�ȣ�����ʹ��ѧƽ�������ƶ����Ӷ�����ʹ������Ӧ���ת������ߣ��Ӷ������H2��ת���ʣ�A��ȷ��
B.�����¶�(773K)Զ�������£���Ҫ����Ϊ�ڴ��¶��´����Ļ���������ڸ÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����������¶ȣ���ѧƽ�������ƶ�����Ӧ��ƽ��ת���ʽ��ͣ�B����
C.���¶ȡ�ѹǿһ��ʱ����ԭ����(N2��H2�ı�������)�����������������壬���ڲ��ܸı��κ�һ�ַ�Ӧ���Ũ�ȣ���˶�����ƽ��ת������Ӱ�죬C����
D.��������Ҫ�ɷ���N2��O2����������ɵ�N2��ͨ����Ȼ����ˮ����ת���ɵ�H2��ԭ����N2��H2���뾭�������������Է�ֹ�����ж�����ʧȥ�����Լ�������ȫ�¹ʷ�����D��ȷ��
�ʺ���ѡ����AD��
(2)�ٴ���������ǿ�������Σ�����Һ��ClO-�ᷢ��ˮ�ⷴӦ��ClO-+H2O![]() HClO+OH-�����մﵽƽ��ʱ����Һ��c(OH-)>c(H+)��������Һ�Լ��ԣ�
HClO+OH-�����մﵽƽ��ʱ����Һ��c(OH-)>c(H+)��������Һ�Լ��ԣ�
��ClO-��ˮ��ƽ�ⳣ��K=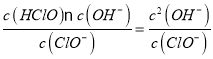 =1.0��10-6mol/L��c2(OH-)=1.0mol/L��1.0��10-6mol/L=1.0��10-6mol2/L2������c(OH-)=1.0��10-3mol/L����c(H+)=
=1.0��10-6mol/L��c2(OH-)=1.0mol/L��1.0��10-6mol/L=1.0��10-6mol2/L2������c(OH-)=1.0��10-3mol/L����c(H+)= =1.0��10-11mol/L��������Һ��pH=11��
=1.0��10-11mol/L��������Һ��pH=11��
��(i)N2(g)+2O2(g)=N2O4(l) ��H=-19.5kJ/mol
(ii)N2H4(l)+O2(g)=N2(g)+2H2O(g) ��H=-534.2kJ/mol
(ii)��2-(i)�������ɵ�2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ��H=-1048.9kJ/mol
(3)��ӦNH4++HCO3-+H2O![]() NH3��H2O+H2CO3��ƽ�ⳣ��K=
NH3��H2O+H2CO3��ƽ�ⳣ��K=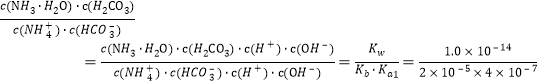 =1.25��10-3��
=1.25��10-3��

����Ŀ���±�ΪԪ�����ڱ���һ���֣������г�12��Ԫ�������ڱ��е�λ�ã���ش�
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
һ | �� | |||||||
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | |||
�� | �� | �� |
��1����12��Ԫ���У���ѧ��������õ�Ԫ����______����Ԫ�ط��Ż�ѧʽ����ͬ�����õ���������ǿ��ԭ����______�������µ���ΪҺ̬�ķǽ���������____________��
��2��ʧ����������ǿ�ĵ�����ˮ��Ӧ�����ӷ�Ӧ����ʽ��________________��
��3��д���ߢ������γɵļ����������ȶ��ķ���ʽ________��д���������Ԫ������������Ӧˮ���������Խ����Ļ�ѧʽ________ ��
��4��д���������γɵĻ������зе���͵Ļ�ѧʽ______������ǿ�Ļ�ѧʽ_______��
��5��д���ܵĵ����û����ߵĵ��ʵĻ�ѧ��Ӧ����ʽ��__________________���ں͢�����Ԫ������������Ӧ��ˮ�������Ӧ�����ӷ���ʽΪ_____________��
��6���õ���ʽ��ʾ�������ɵĶ�Ԫ��������γɹ���________________________��
����Ŀ����֪:��36 g ̼����ȫȼ�����������У�COռ1/3�����CO2ռ2/3�������֪C(s) +1/2O2(g) = CO(g) ��H = ��110.5 kJ/mol CO(g) +1/2O2(g) = CO2(g) ��H = ��283 kJ/mol������˵���������
A. ����Щ̼��ȫȼ����ȣ�̼����ȫȼ����ʧ�������� 283kJ
B. CO2(g)= C(s) + O2(g) ��H = +393��5 kJ/mol
C. 3mol C(s)��2mol O2(g)��ȫ��Ӧ�ų�������Ϊ614.5 kJ
D. ��֪��صĻ�ѧ��������������
��ѧ�� | H��H | C��O |
| H��O | C��H |
E/(kJ��mol��1) | 436 | 343 | 1 076 | 465 | 413 |
��CO(g)��2H2(g)![]() CH3OH(g)����H= +99 kJ/mol
CH3OH(g)����H= +99 kJ/mol




