题目内容
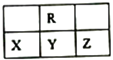
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只能有共价键
C. 由X、Y两种元素形成的化合物都是酸性氧化物
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
【答案】D
【解析】假设X的原子最外层电子数是a,则W是a-1、Y是a+1、Z是a+2,因此4a+2=22,所以a=5,所以X是N、Y是O、Z是Cl、W是Si、T是Ge。A.X、Y、Z三种元素最低价氢化物分别是NH3、H2O、HCl,由于在NH3、H2O的分子之间都存在氢键,增加了分子之间的吸引力,是物质的熔沸点升高,在H2O的分子之间吸引力最强,因此沸点最高,NH3次之,HCl最小,A错误;B.由X、Y和氢三种元素形成的化合物如NH4NO3、NH4NO2中含有共价键、离子键,B错误;C.NO、NO2等均不是酸性氧化物,C错误;D.由于T元素在元素周期表中处于金属与非金属的交界区,所以T元素的单质具有半导体的特性,T最外层有4个电子,Z最外层有7个电子,所以T与Z元素可形成化合物TZ4,D正确。答案选D。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】某同学设计如图所示装置分别进行探究实验(夹持装置已略去) 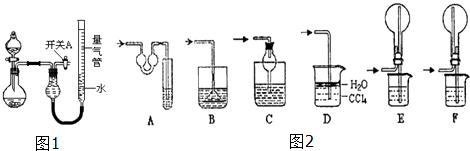
实验 | 药品 | 制取气体 | 量气管中的液体 |
① | Cu、稀HNO3 | H2O | |
② | NaOH固体、浓氨水 | NH3 | |
③ | Na2CO3固体、稀H2SO4 | CO2 | |
④ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
请回答下列问题:
(1)简述如何检查该装置的气密性: .
(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度.你认为是否可行?请简述原因. .
(3)实验②中剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3 , 而且能防止倒吸的有
(4)实验③中,量气管中的液体最好是 .
A.H2O
B.CCl4
C.饱和Na2CO3溶液
D.饱和NaHCO3溶液
(5)本实验应对量气管多次读数,读数时应注意: ①恢复至室温,② , ③视线与凹液面最低处相平.
(6)实验④获得以下数据(所有气体体积均已换算成标准状况)
编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
① | 1.0g | 10.0mL | 346.3mL |
② | 1.0g | 10.0mL | 335.0mL |
③ | 1.0g | 10.0mL | 345.7mL |
根据上述合理数据计算镁铝合金中铝的质量分数 .