题目内容
工业上用软锰矿(主要成分为MnO2)制备高锰酸钾的工艺流程如图所示: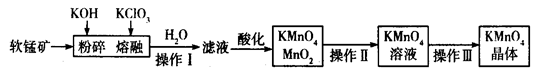
(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。下列 酸能用于酸化高锰酸钾溶液的是____________(填序号)。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.氢硫酸 |
(3)软锰矿与过量固体KOH和KClO3在熔融状态下反应时的氧化剂是__________________(填化学式)。反应后加水溶解得到的滤液中主要含有KCl和K2MnO4,则滤液酸化时发生反应的离子方程式为 _______________________________。
(4)已知KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2。取上述制得的KMnO4产品0.33 g,恰好与0.67 g Na2C2O4完全反应,则KMnO4的纯度为________%。
(10分)
(1)b (1分)
(2) 过滤(1分) 过滤(1分) 蒸发(1分)
(3)KClO3(1分);3MnO42-+4H+=2MnO4-+MnO2↓+2H2O(2分)
(4)96(3分)
解析 试题分析:(1)高锰酸钾能氧化盐酸和氢硫酸,硝酸本身具有强氧化性,故选硫酸;(2) 由进行操作Ⅰ后得滤液,故操作Ⅰ应为过滤,由于MnO2难溶于水操作Ⅱ后得KMnO4溶液,故操作Ⅱ为过滤,进行操作Ⅲ后使溶液变成了晶体,故操作Ⅲ为蒸发;(3)由产物及元素的化合价可知氧化剂应为KClO3,滤液中主要成分是K2MnO4,酸化后得到KMnO4和MnO2,故方程式为:3MnO42-+4H+=2MnO4-+MnO2↓+2H2O;(4)由题意及电子守恒可得关系式为:
试题分析:(1)高锰酸钾能氧化盐酸和氢硫酸,硝酸本身具有强氧化性,故选硫酸;(2) 由进行操作Ⅰ后得滤液,故操作Ⅰ应为过滤,由于MnO2难溶于水操作Ⅱ后得KMnO4溶液,故操作Ⅱ为过滤,进行操作Ⅲ后使溶液变成了晶体,故操作Ⅲ为蒸发;(3)由产物及元素的化合价可知氧化剂应为KClO3,滤液中主要成分是K2MnO4,酸化后得到KMnO4和MnO2,故方程式为:3MnO42-+4H+=2MnO4-+MnO2↓+2H2O;(4)由题意及电子守恒可得关系式为:
2KMnO4~5NaC2O4
2×158 5×134
m 0.67g
解得m=0.316g
KMnO4的纯度为0.316/0.33×100%=86%
考点:考查氧化还原反应及计算、化学实验基本操作等知识点。

化学实验研究的常用方法,
| A.蒸馏 | B.萃取 | C.过滤 | D.结晶 E.分液 F.纸上层析,请填空(填字母): |
用四氯化碳提取溴水中的溴单质的方法 ;
分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)的方法 ;
从含有少量氯化钠的硝酸钾溶液中提取硝酸钾的方法 。
海洋植物如海带、海藻中含有丰富的碘元素,其主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
(1)指出提取碘的过程中有关的实验操作名称:① ,③ ;
(2)操作③中所用的有机试剂可以是 (只填一种),简述选择其理由 。
(3)操作过程③可以分解为如下几步:
| A.把盛有溶液的分液漏斗放在铁架台的铁圈中; |
| B.把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞; |
| C.检验分液漏斗活塞和上口的玻璃塞是否漏液; |
| D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; |
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(a)过程③正确操作步骤的顺序是:(填编号字母) ;
(b)上述G步操作的目的是: ;
选择下列物质分离和检验方法,将其选项填在横线上。
| A.萃取; | B.升华; | C.结晶; | D.分液;E.蒸馏;F.层析;G.过滤 |
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾 。
(3)分离水和汽油的混合物 。
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体 。

 MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。



