��Ŀ����
����Ŀ������ˮ�����ǹ�ϵ���ཡ������Ҫ���⡣
(1)Cl2��������������ˮ���������ʣ�д��Cl2����ˮ������Ӧ�����ӷ���ʽ________________��
(2)C1O2��һ�ָ�Ч���Ͷ�������������ȡ��Cl2��Ϊ��������ˮ����������KClO3��SO2��ǿ������Һ�з�Ӧ���Ƶ�C1O2���˷�Ӧ�����ӷ���ʽΪ_________________��ClO2�ɽ���ˮ�е�Mn2+ת��ΪMnO2����ȥ��������ԭΪCl-���÷�Ӧ�������������뻹ԭ�������ʵ���֮��Ϊ___________��
(3)�������(K2FeO4)��һ�����͡���Ч�����ˮ����������Cl2��ClO2�����Ը�ǿ��������Ⱦ����ɫˮ����������ҵ�����Ƶø������ƣ�Ȼ���ڵ����£������������Һ�м���KOH�����;Ϳ�����������ء���������Ϣ��֪����ͬ�����£����������ܽ�ȱȸ�������ܽ��______ (������������С��)���ɷ��Ʊ��������Ƶ���Ҫ��ӦΪ2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2�����÷�Ӧÿ����1 molNa2FeO4ת��____mol���ӡ�
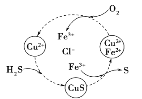
(4)��H2S�Ϳ����Ļ������ͨ��FeCl3��FeCl2��CuCl2�Ļ����Һ�з�Ӧ���Ի���S��������ת����ͼ��ʾ����ͼʾ��ת���У����ϼ۲����Ԫ����_______����ͼʾ���ܷ�ӦΪ ______��
���𰸡�Cl2+H2O�TH++Cl��+HClO 2ClO3��+SO2�T2ClO2+SO42�� 2��5 �� 5 H��Cl��Cu 2H2S+O2=2S![]() +2H2O
+2H2O
��������
��1��������ˮ��Ӧ����HCl��HClO��
��2��KClO3��SO2��ǿ������Һ�з�Ӧ���Ƶ�C1O2����֪SO2��������SO42���������ӷ�ӦΪ2ClO3��+SO2�T2ClO2+SO42����ClO2�ɽ���ˮ�е�Mn2+ת��ΪMnO2����ȥ��������ԭΪCl-�������ӷ���ʽΪ2ClO2+ 5Mn2++6H2O=5MnO2+ 2Cl-+12H+����֪�÷�Ӧ�������뻹ԭ�����ʵ���֮�ȣ�
��3���ڵ����£�����������ױ�ɹ���������˵����������ڵ����µ��ܽ�ȱȸ������Ƶ��ܽ��С����Ӧ2FeSO4+6Na2O2�T2 Na2FeO4+2Na2O+2Na2SO4+O2����FeԪ�ػ��ϼ����ߣ���������OԪ�ػ��ϼ��ɩ�1�۱�Ϊ��2�ۡ�0�ۣ���ϻ��ϼ۵ı仯�����⣻
��4����ͼʾ��Ӧԭ������Һ��H2O�е�H+��Cl-��Cu2+û�в���������ԭ����H��Cl��Cu����Ԫ�صĻ��ϼ�û�б仯��
��1����������ˮ�������˴���������ᣬ���ӷ�ӦΪCl2+H2O�TH++Cl��+HClO���ʴ�Ϊ��Cl2+H2O�TH++Cl��+HClO��
��2��KClO3��SO2��ǿ������Һ�з�Ӧ���Ƶ�C1O2����֪SO2��������SO42���������ӷ�ӦΪ2ClO3��+SO2�T2ClO2+SO42����ClO2�ɽ���ˮ�е�Mn2+ת��ΪMnO2����ȥ��������ԭΪCl-�������ӷ���ʽΪ2ClO2+ 5Mn2++6H2O=5MnO2+ 2Cl-+12H+����֪�÷�Ӧ�������뻹ԭ�����ʵ���֮��n(ClO2)��n(Mn2+)=2��5���ʴ�Ϊ2ClO3��+SO2�T2ClO2+SO42����2��5��
��3���ڵ����£�����������ױ�ɹ���������˵����ͬ�����£����������ܽ�ȱȸ�������ܽ�ȴ�Ӧ2FeSO4+6Na2O2�T2 Na2FeO4+2Na2O+2Na2SO4+O2���У�ÿ����l mol Na2FeO4ͬʱ����0.5mol��������ת�Ƶ���Ϊ1mol����6��2��+0.5mol��2��[0������1��]��5mol���ʴ�Ϊ���� 5��
��4����ͼʾ��Ӧԭ������Һ��H2O�е�H+��Cl-��Cu2+û�в���������ԭ����H��Cl��Cu����Ԫ�صĻ��ϼ�û�б仯������Ԫ����O��Fe��S�Ļ��ϼ۾��б仯����ͼʾ���ܷ�ӦΪ2H2S+O2=2S![]() +2H2O���ʴ�Ϊ��H��Cl��Cu��2H2S+O2=2S
+2H2O���ʴ�Ϊ��H��Cl��Cu��2H2S+O2=2S![]() +2H2O��
+2H2O��

 ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�