题目内容
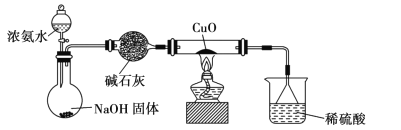
【题目】实验室制乙烯,常因温度过高生成少量SO2,有人设计了如图所示实验,以验证上述混合气体中是否含有乙烯和SO2。
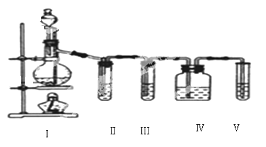
(1)在烧瓶中除了加入乙醇、浓硫酸外,还应放入几块碎瓷片,其目的是:____。
(2)写出生成乙烯的反应方程式:____。
(3)Ⅱ、Ⅲ、Ⅳ、Ⅴ、装置中盛放的试剂是(从下列所给试剂中选出,填序号)
①品红溶液,②NaOH溶液,③酸性KMnO4溶液。则正确的排列顺序为:_____。
(4)能说明SO2气体存在的现象是____。
(5)确证含有乙烯的现象是____。
【答案】防止暴沸 C2H5OH![]() CH2=CH2↑ +H2O ①②①③ Ⅱ中品红溶液褪色 Ⅳ中品红溶液不褪色,Ⅴ中酸性KMnO4溶液褪色
CH2=CH2↑ +H2O ①②①③ Ⅱ中品红溶液褪色 Ⅳ中品红溶液不褪色,Ⅴ中酸性KMnO4溶液褪色
【解析】
由实验装置图可知,装置Ⅰ中乙醇在浓硫酸作用下,加热到170℃发生消去反应生成乙烯和水,实验是需要用温度计控制反应温度,需要加入碎瓷片防止暴沸;装置Ⅱ中盛有品红溶液,用于检验二氧化硫的生成;装置Ⅲ中盛有氢氧化钠溶液,用于吸收二氧化硫,防止二氧化硫干扰乙烯的检验;装置Ⅳ盛有品红溶液,用于证明二氧化硫被完全吸收;装置Ⅴ盛有酸性KMnO4溶液,用于检验乙烯的生成。
(1)液体加热时会发生暴沸现象,为防止暴沸发生,常加入几块碎瓷片,故答案为:防止暴沸;
(2)乙醇在浓硫酸作用下,加热到170℃发生消去反应生成乙烯和水,反应的化学方程式为C2H5OH![]() CH2=CH2↑ +H2O,故答案为:C2H5OH
CH2=CH2↑ +H2O,故答案为:C2H5OH![]() CH2=CH2↑ +H2O;
CH2=CH2↑ +H2O;
(3)乙烯和SO2都具有还原性,都能使酸性KMnO4溶液褪色,为防止二氧化硫干扰乙烯的检验,应先检验并吸收二氧化硫,则装置Ⅱ中盛有品红溶液,用于检验二氧化硫的生成;装置Ⅲ中盛有氢氧化钠溶液,用于吸收二氧化硫,防止二氧化硫干扰乙烯的检验;装置Ⅳ盛有品红溶液,用于证明二氧化硫被完全吸收;装置Ⅴ盛有酸性KMnO4溶液,用于检验乙烯的生成,故答案为:①②①③;
(3)装置Ⅱ中盛有品红溶液,用于检验二氧化硫的生成,装置Ⅱ中的品红溶液褪色说明存在二氧化硫气体,故答案为:Ⅱ中品红溶液褪色;
(4)装置Ⅳ中的品红不褪色,说明二氧化硫已除尽,装置Ⅴ中的高锰酸钾褪色,说明存在乙烯气体,故答案为:Ⅳ中品红溶液不褪色,Ⅴ中酸性KMnO4溶液褪色。