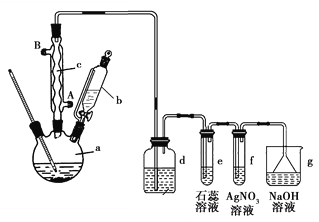
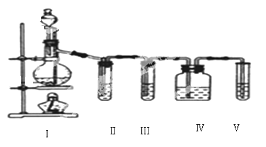
题目内容
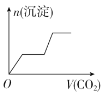
【题目】镁铝合金5.1 g溶于300 mL2 mol·L-1盐酸中,标准状况下放出气体的体积为5.6 L,向反应后的溶液中加入500 mLNaOH溶液充分反应,最终产生白色沉淀。下列有关说法不正确的是
A.5.1 g镁铝合金中含有镁、铝的质量分别为2.4 g、2.7 g
B.溶解5.1 g镁铝合金时,剩余盐酸中溶质的物质的量为0.1 mol
C.若白色沉淀只有Mg(OH)2,该NaOH溶液的物质的量浓度至少为1.2 mol·L-1
D.生成白色沉淀的最大质量为13.6 g
【答案】C
【解析】
Mg、Al与HCl发生反应Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,5.6 L气体是H2,该H2的物质的量n(H2)=![]() =0.25 mol,故根据H元素守恒可知参加反应的HCl的物质的量n(HCl)=0.25 mol×2=0.5 mol,溶液中n(HCl)总=2 mol/L×0.3 L=0.6 mol,大于参加反应的HCl的物质的量,故金属完全反应。向反应后溶液中加入一定量烧碱溶液,生成沉淀的质量最大,则Mg2+、Al3+恰好完全转化为Mg(OH)2、Al(OH)3,则m(沉淀)=m(金属)+m(OH-),根据电子守恒计算n(OH-),再根据m=n·M计算m(OH-)。
=0.25 mol,故根据H元素守恒可知参加反应的HCl的物质的量n(HCl)=0.25 mol×2=0.5 mol,溶液中n(HCl)总=2 mol/L×0.3 L=0.6 mol,大于参加反应的HCl的物质的量,故金属完全反应。向反应后溶液中加入一定量烧碱溶液,生成沉淀的质量最大,则Mg2+、Al3+恰好完全转化为Mg(OH)2、Al(OH)3,则m(沉淀)=m(金属)+m(OH-),根据电子守恒计算n(OH-),再根据m=n·M计算m(OH-)。
A.假设镁、铝的物质的量分别为x mol、y mol,根据电子守恒可得2x+3y=0.25×2 mol;根据金属质量关系可得:24x+27y=5.1 g,解得x=0.1 mol,y=0.1 mol,所以金属Mg的质量为m(Mg)=0.1 mol×24 g/mol=2.4 g,金属Al的质量m(Al)= 0.1 mol×27 g/mol=2.7 g,A正确;
B.n(H2)=![]() =0.25 mol,故参加反应的HCl的物质的量n(HCl)反应=0.25 mol×2=0.5 mol,300 mL2 mol·L-1盐酸中HCl的物质的量溶液中n(HCl)总=2 mol/L×0.3 L=0.6 mol,所以剩余盐酸的物质的量n(HCl)剩余=0.6 mol -0.5 mol=0.1 mol,B正确;
=0.25 mol,故参加反应的HCl的物质的量n(HCl)反应=0.25 mol×2=0.5 mol,300 mL2 mol·L-1盐酸中HCl的物质的量溶液中n(HCl)总=2 mol/L×0.3 L=0.6 mol,所以剩余盐酸的物质的量n(HCl)剩余=0.6 mol -0.5 mol=0.1 mol,B正确;
C.若镁离子和铝离子完全转化为白色沉淀,此时沉淀的质量最大,溶液为NaCl溶液,溶质为NaCl,根据钠元素守恒可知,n(NaOH)=n(NaCl)=n(HCl)=0.6 mol,则该NaOH溶液的物质的量浓度c(NaOH)=![]() =1.2 mol/L。若白色沉淀只有Mg(OH)2,则需要把氢氧化铝溶解,因此NaOH溶液的物质的量浓度一定大于1.2 mol/L,C错误;
=1.2 mol/L。若白色沉淀只有Mg(OH)2,则需要把氢氧化铝溶解,因此NaOH溶液的物质的量浓度一定大于1.2 mol/L,C错误;
D.根据电子注意守恒可知n(OH-)=2n(H2)=2×0.25 mol=0.5 mol,则反应产生沉淀的最大质量为m(沉淀)=m[Mg(OH)2]+m[Al(OH)3]=m(Mg)+m(Al)+m(OH-)=5.1 g+0.5 mol×17 g/mol=13.6 g,D正确;
故合理选项是C。

【题目】碳氧化物研究
![]() 和
和![]() 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇:![]() ,现在体积为1L的恒容密闭容器
,现在体积为1L的恒容密闭容器![]() 图甲
图甲![]() 中通入1molCO和
中通入1molCO和![]() ,测定不同时间、不同温度
,测定不同时间、不同温度![]() 下容器中CO的物质的量,如表:
下容器中CO的物质的量,如表:

0min | 10min | 20min | 30min | 40min | |
| 1mol |
|
|
|
|
| 1mol |
|
| a | a |
请回答:
![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]() ,理由是______。已知
,理由是______。已知![]() 时,第20min时容器内压强不再改变,此时
时,第20min时容器内压强不再改变,此时![]() 的转化率为______,该温度下的化学平衡常数为______。
的转化率为______,该温度下的化学平衡常数为______。
![]() 若将1molCO和
若将1molCO和![]() 通入原体积为1L的恒压密闭容器
通入原体积为1L的恒压密闭容器![]() 图3乙
图3乙![]() 中,在
中,在![]() 下达到平衡,此时反应的平衡常数为______;若再向容器中通入
下达到平衡,此时反应的平衡常数为______;若再向容器中通入![]() ,重新达到平衡后,
,重新达到平衡后,![]() 在体系中的百分含量______
在体系中的百分含量______![]() 填“变大”或“变小”或“不变”
填“变大”或“变小”或“不变”![]() 。
。
![]() 一定条件下也可用NaOH溶液与CO反应生成甲酸钠,进一步反应生成甲酸来消除CO污染。常温下将amol的CO通入
一定条件下也可用NaOH溶液与CO反应生成甲酸钠,进一步反应生成甲酸来消除CO污染。常温下将amol的CO通入![]() NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液
NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液![]() 假设溶液体积不变
假设溶液体积不变![]() ,测得溶液中
,测得溶液中![]() ,则该混合溶液中甲酸的电离平衡常数
,则该混合溶液中甲酸的电离平衡常数![]() ______
______![]() 用含a和b的代数式表示
用含a和b的代数式表示![]()