题目内容
【题目】今有室温下的四种溶液:①pH=2的醋酸;②pH=a的Na2CO3溶液,体积为VL;③pH=2的硫酸;④pH=12的氢氧化钠溶液。下列有关说法正确的是( )
A.将②溶液用蒸馏水稀释,使体积扩大10倍,所得溶液pH变为(a-1)
B.V1L③溶液和V2L④溶液混合,若混合后溶液pH=3,则V1:V2=11:9
C.①与④两溶液等体积混合,混合液pH=7
D.①与③两溶液的物质的量浓度相等
【答案】B
【解析】
A.碳酸钠是强碱弱酸盐,因为碳酸根离子水解使溶液显弱碱性。溶液用蒸馏水稀释,使体积扩大10倍,若碳酸根离子水解程度不变,则溶液中氢氧根离子的浓度减小为原来的十分之一,即PH变为a-1,但加水稀释,碳酸根离子水解平衡正向移动,所以溶液中氢氧根离子的浓度比原来的十分之一要大,A错误;
B.③和④是强酸和强碱溶液,根据混合后溶液pH=3可以得到混合后溶液中H+的浓度为10-3mol/L,所以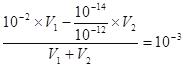 计算得V1:V2=11:9,所以B正确;
计算得V1:V2=11:9,所以B正确;
C.由于醋酸是弱酸,溶液中还存在醋酸分子所以①与④两溶液等体积混合,混合液pH小于7,C错误;
D.硫酸属于二元强酸,醋酸属于弱酸当PH相同时,二者的浓度不同,D错误;
所以答案选B。

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目