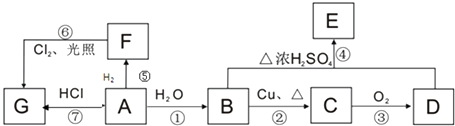
题目内容
【题目】盛有NO和NO2 的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半.
(1)写出有关反应的化学方程式.
(2)原混合气体中NO和NO2的体积比是多少?
【答案】
(1)解:NO2通入水中,发生反应:3NO2+H2O=2HNO3+NO,
答:有关反应方程式为3NO2+H2O=2HNO3+NO.
(2)解:过一段时间后,量筒内的气体体积减小为原来的一半,则物质的量减小一半,
设混合气体中含有xmolNO,ymolNO2,则:
3NO2+ | H2O | = | 2HNO3+ | NO |
3 | 1 | |||
ymol |
|
所以,(x+ ![]() ):(x+y)=1:2,
):(x+y)=1:2,
解之得:x:y=1:3,
答:原混合气体中NO和NO2的体积比是1:3.
【解析】NO2通入水中,发生:3NO2+H2O=2HNO3+NO,过一段时间后,量筒内的气体体积减小为原来的一半,则物质的量减小一半,设混合气体中含有xmolNO,ymolNO2 , 根据方程式计算.

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】如表所示为自然界中的多种铜矿石的主要成分:
矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3Cu(OH)2 |
请回答:
(1)上表所列铜化合物中,铜的质量百分含量最高的是(填化学式)
(2)工业上以黄铜矿为原料.采用火法溶炼工艺生产铜.该工艺的中间过程包含反应: 2Cu2O+Cu2S ![]() 6Cu+SO2↑,则该反应的氧化剂与还原剂的物质的量之比是
6Cu+SO2↑,则该反应的氧化剂与还原剂的物质的量之比是
(3)火法溶炼工艺生产铜的尾气直接排放到大气中造成环境污染的后果是;处理该尾气可得到有价值的化学品,写出其中一种酸和一种盐的名称或化学式、 .
(4)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是(填字母).
选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
A | 铜绿的主成分是碱式碱酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
B | 铜表易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
C | 铁比铜活泼 | 铆在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |