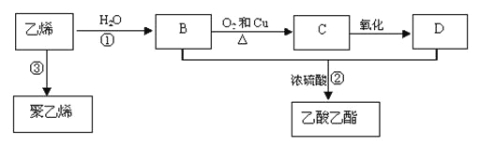
题目内容
【题目】Ⅰ.某温度下,在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t1 min时到达平衡,如图所示:
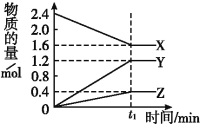
(1)该反应的化学方程式是 。
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为 ;在此t1 min时间内,用H2表示反应的平均速率v(H2)为 。
Ⅱ. 亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:
5Na2SO3+2KIO3+H2SO4 ===5Na2SO4+K2SO4+I2+H2O,
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)
②IO2-+2SO32-→I-+2SO42-(快)
③5I-+6H++IO3-→3I2+3H2O(快)
④I2+SO32-+H2O→2I-+SO42-+2 H+(快)
(1)根据上述条件推测,此反应的总的反应速率由 步反应决定。(填“①、②、③、④”)。
(2)若预先加入淀粉溶液,由题述看,必须在 离子消耗完时,才会使淀粉变蓝的现象产生。
【答案】Ⅰ.(1)2X![]() 3Y+Z
3Y+Z
(2)36.8 kJ;![]() mol/(L·min)
mol/(L·min)
Ⅱ. (1)①
(2)SO32-
【解析】
试题分析:Ⅰ.(1)由图象可以看出,X的物质的量逐渐减小,则X为反应物,Y、Z的物质的量逐渐增多,作为Y、Z为生成物,当反应到达2min时,△n(X)=0.8mol,△n(Y)=1.2mol,△n(Z)=0.4mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(X):△n(Y):△n(Z)=2:3:1,所以反应的化学方程式为:2X![]() 3Y+Z。
3Y+Z。
故答案为:2X![]() 3Y+Z;
3Y+Z;
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量。则至t1 min时,由图像可知发生分解的氨气的物质的量为0.8mol,该反应吸收的热量为46×0.8=36.8 (kJ)在此t1 min时间内,用H2表示反应的平均速率v(H2)为![]() mol/(L·min)。
mol/(L·min)。
故答案为:36.8 kJ;![]() mol/(L·min);
mol/(L·min);
Ⅱ. (1)由慢反应决定整个反应过程的速率,反应经历四步,其中①步较慢,其它步非常迅速,故反应速率由①步反应决定。
故答案为:①;
(2)由反应④可知,SO32-的还原性大于I-,可被I2氧化,故需消耗完SO32-,才会生成I2,才会有溶液变
蓝的现象产生。
故答案为:SO32-。

 习题精选系列答案
习题精选系列答案