题目内容
17. 用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体.请回答问题:
用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体.请回答问题:(1)实验过程如图所示,分析判断:EF段(选:OE或EF或FG)化学反应速率最大.
(2)分析整个过程反应速率变化的原因E→F段溶液温度升高,反应速率加快,F→G,盐酸浓度降低,反应速率减慢
(3)为了减缓上述化学反应的速率,欲向溶液中加入下列物质,你认为可行的是AC.
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.浓盐酸.
分析 (1)根据曲线斜率判断反应速率;
(2)碳酸钙跟稀盐酸反应放热,溶液温度升高,反应速率加快,F→G,盐酸浓度降低,反应速率减慢;
(3)增大浓度、升高温度、增大接触面积等均可加快反应速率,反之,减小反应物的浓度,反应速率减慢.
解答 解:(1)曲线斜率大小决定反应速率大小,斜率越大,反应速率越快,所以是EF段,故答案为:EF;
(2)E→F段反应速率加快,是因为反应放热,溶液温度升高,F→G段反应速率减慢,是因为盐酸浓度降低,故答案为:E→F段溶液温度升高,反应速率加快,F→G,盐酸浓度降低,反应速率减慢;
(3)A.加入蒸馏水,盐酸浓度减小,反应速率减慢,故A正确;
B.加入氯化钠固体,反应物浓度不变,反应速率不变,故B错误;
C.加入NaCl溶液,氢离子浓度减小,反应速率减慢,故C正确;
D.加入浓盐酸,氢离子浓度增大,反应速率加快,故D错误.
故答案为:AC.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度对反应速率的影响为解答的关键,注重基础知识的考查,注意图象的分析,题目难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
8.关于元素周期表的说法正确的是( )
| A. | 元素周期表有7个周期,8个主族 | |
| B. | 最外层电子数相同的元素一定在同一族 | |
| C. | 短周期元素中可能有副族元素 | |
| D. | 元素周期表有18个纵行,共16个族 |
5.下表列出了A~R九种元素在周期表的位置,请用化学用语填空:
(1)写出R单质分子的电子式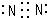 .A的最高价氧化物对应的水化物的电子式
.A的最高价氧化物对应的水化物的电子式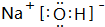 .
.
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式),H、I、G三种元素氢化物中,最稳定的是HCl(填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g.X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X的原子结构示意图是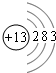 ,X的单质和氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
,X的单质和氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
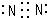 .A的最高价氧化物对应的水化物的电子式
.A的最高价氧化物对应的水化物的电子式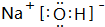 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式),H、I、G三种元素氢化物中,最稳定的是HCl(填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g.X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X的原子结构示意图是
 ,X的单质和氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
,X的单质和氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
12.下列物质中,既有离子键,又有非极性共价键的是( )
| A. | H2SO4 | B. | CaCl2 | C. | NH4Cl | D. | Na2O2 |
2.下列说法或表示方法正确的是( )
| A. | 醛基的电子式: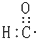 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 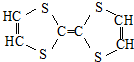 属于有机物 属于有机物 | D. | 聚丙烯的化学式: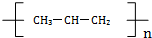 |
7.海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
| A. | 海水中含有溴元素,只需经过化学变化就可以得到高纯度的溴 | |
| B. | 海水淡化涉及到了化学变化 | |
| C. | 从海水中可以得到NaCl,除了食用外,还可以用于工业制氯气 | |
| D. | 海水中含有丰富的钠、镁、碘、金 |