��Ŀ����
����Ŀ������Ӧ�úʹ��������Ļ����������������������Ҫ���塣�ش���������:
(1)�����������������£�������ƫ������[(CH3)2NNH2]�ɿ��ٷ�Ӧ��ƫ������ת��ΪCH3OH��N2���÷�Ӧ�Ļ�ѧ����ʽΪ______________________________��
(2)����������(H2N2O2)��һ�ֶ�Ԫ�ᣬ��������N2O���塣25��ʱ������������ĵ��볣��Ka1��6.17��10-8��Ka2��2.88��10-12
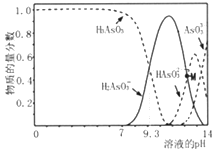
��25��ʱ0.1molL-1NaHN2O2��Һ������Ũ���ɴ�С��˳��Ϊ____________________________��
��25��ʱ��0.1 molL-1������������Һ����ε���NaOH��Һ������Һ��pH��10ʱ��C(N2O22-)/ C(H2N2O2)=________��
(3)�������ȿ���NO��Cl2��Ӧ�Ƶã���Ӧԭ��Ϊ2NO(g)+ Cl2 (g)![]() 2C1NO(g)����Ͷ�ϱ�n(NO)��n(Cl2) ��2:1��NO��Cl2����һ��ѹ���ܱ������з���������Ӧ��NO��ƽ��ת�������¶�T�Ĺ�ϵ��ͼ��ʾ��
2C1NO(g)����Ͷ�ϱ�n(NO)��n(Cl2) ��2:1��NO��Cl2����һ��ѹ���ܱ������з���������Ӧ��NO��ƽ��ת�������¶�T�Ĺ�ϵ��ͼ��ʾ��
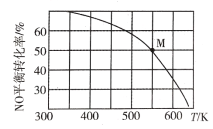
�ٸ÷�Ӧ����H_____(����������������������)0��
��M��ʱ������NO���������Ϊ____��
������Ӧһֱ������Pѹǿ�����½��У���M���ƽ�ⳣ��Kp=____________��(�ú�P�ı���ʽ��ʾ)��
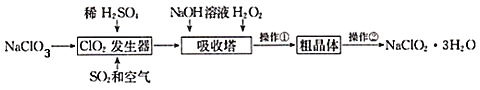
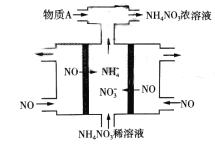
(4)��ҵ�ϵ��NO�Ʊ�NH4NO3���Ա��Ϊ�����乤��ԭ����ͼ��ʾ�����ʱ������ӦʽΪ___________,Ϊʹ������ȫ��ת��ΪNH4NO3����Ҫ��������A������A��ѧʽΪ__________��
���𰸡�2Cl2 + 2H2O + (CH3)2NNH2 = 2CH3OH + N2 + 4HCl c(Na+) > c(HN2O2��) > c(OH��) > c(H+) > c(N2O22��) 17.8 < 40% ![]() NO �� 3e�� +2 H2O = 4H+ +NO3�� NH3
NO �� 3e�� +2 H2O = 4H+ +NO3�� NH3
��������
(1)������ƫ������[(CH3)2NNH2]�ɿ��ٷ�Ӧ����CH3OH��N2�����ᣬ����������ԭ��Ӧд����Ӧ�Ļ�ѧ����ʽ��
(2)��25��ʱ0.1molL-1NaHN2O2��Һˮ�ⳣ�������ƽ�ⳣ���Ƚϣ�ˮ��ռ��Ҫ���ó�����Ũ���ɴ�С��˳����25��ʱ��0.1 molL-1������������Һ����ε���NaOH��Һ������Һ��pH��10ʱ������ƽ�ⳣ����˵ó���
(3)����ͼ�������¶ȣ�ת���ʼ�С��ƽ�������ƶ������������ȷ�Ӧ����n(NO)��n(Cl2) ��2:1������n(NO) ��2mol��n(Cl2) ��1mol��M��ʱNOת����Ϊ50%������ʽ������ϵ����ó���������ͱ�ʾ��ѹǿƽ�ⳣ����
(4)����ʾ��ͼ�������仯NO �� NO3��������NO �� NH4+�����ݵ缫��Ӧ����ʽ��д�������������ʻ�����ƽ�⣬�����·��������ת�Ƶ�����Ŀ���ʱ��������n(NO3��) > n(NH4+)������Ҫʹ������ȫ��ת��ΪNH4NO3���ó���Ҫ��������ʡ�
(1)������ƫ������[(CH3)2NNH2]�ɿ��ٷ�Ӧ����CH3OH��N2�����ᣬ��Ӧ�Ļ�ѧ����ʽΪ 2Cl2 + 2H2O + (CH3)2NNH2 = 2CH3OH + N2 + 4HCl���ʴ�Ϊ��2Cl2 + 2H2O + (CH3)2NNH2 = 2CH3OH + N2 + 4HCl��
(2)��25��ʱ0.1molL-1NaHN2O2��Һˮ�ⳣ��![]() ��ˮ��ռ��Ҫ����Һ�Լ��ԣ��������Ũ���ɴ�С��˳��Ϊc(Na+) > c(HN2O2��) > c(OH��) > c(H+) > c(N2O22��)���ʴ�Ϊ��c(Na+) > c(HN2O2��) > c(OH��) > c(H+) > c(N2O22��)��
��ˮ��ռ��Ҫ����Һ�Լ��ԣ��������Ũ���ɴ�С��˳��Ϊc(Na+) > c(HN2O2��) > c(OH��) > c(H+) > c(N2O22��)���ʴ�Ϊ��c(Na+) > c(HN2O2��) > c(OH��) > c(H+) > c(N2O22��)��
��25��ʱ��0.1 molL-1������������Һ����ε���NaOH��Һ������Һ��pH��10ʱ����![]() ��
��![]() ���ʴ�Ϊ��17.8��
���ʴ�Ϊ��17.8��
(3)����ͼ�������¶ȣ�ת���ʼ�С��ƽ�������ƶ������������ȷ�Ӧ��������ȷ�Ӧ���÷�Ӧ����H �� 0���ʴ�Ϊ������
��n(NO)��n(Cl2) ��2:1������n(NO) ��2mol��n(Cl2) ��1mol��M��ʱNOת����Ϊ50%��
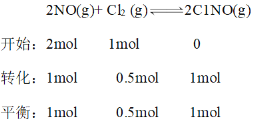
M��ʱ������NO���������Ϊ![]() ����Ϊ40%��
����Ϊ40%��
������Ӧһֱ������Pѹǿ�����½��У���M���ƽ�ⳣ��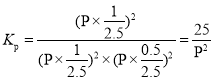 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(4)����ʾ��ͼ�������仯NO �� NO3��������NO �� NH4+�����ݵ缫��Ӧ����ʽ��д�������������ʻ�����ƽ�⣬������д��������������ʽ�ֱ�Ϊ��NO + 5e�� + 6 H+ = H2O + NH4+��NO �� 3e�� +2 H2O = 4H+ +NO3���������·��������ת�Ƶ�����Ŀ���ʱ������n(NO3��) > n(NH4+)������Ҫʹ������ȫ��ת��ΪNH4NO3����Ҫ����NH3�������ӷ�Ӧ����NH4+���ʴ�Ϊ��NO �� 3e�� +2 H2O = 4H+ +NO3����NH3��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�