题目内容
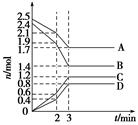
甲醇可通过将煤气化过程中生成的CO和H2在一定条件下,发生如下反应制得:CO(g)+2H2(g)  CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= ,CO的转化率为 。
(2)该反应的平衡常数表达式为 ,温度升高,平衡常数 (填“增大”、“减小”或“不变”)。
(3)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则加入各物质后该反应向 (填“正”、“逆”)反应方向移动,理由是 。
 CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= ,CO的转化率为 。
(2)该反应的平衡常数表达式为 ,温度升高,平衡常数 (填“增大”、“减小”或“不变”)。
(3)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则加入各物质后该反应向 (填“正”、“逆”)反应方向移动,理由是 。
(1)0.15 mol·L-1·min-1 75%
(2)K= 减小
减小
(3)正 反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积减小,平衡正移
(2)K=
 减小
减小(3)正 反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积减小,平衡正移
解答该题应该注意下面三点:
(1)根据图一和已知反应方程式计算反应速率及转化率。
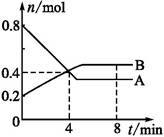
(2)根据图二判断反应过程中的能量变化及反应是吸热反应还是放热反应,从而判断平衡常数随温度的变化。
(3)ρ=m/V,质量不变,密度增大,体积减小,从而判断反应方向。
(1)根据图一和已知反应方程式计算反应速率及转化率。
(2)根据图二判断反应过程中的能量变化及反应是吸热反应还是放热反应,从而判断平衡常数随温度的变化。
(3)ρ=m/V,质量不变,密度增大,体积减小,从而判断反应方向。

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
 SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____ kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____ kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。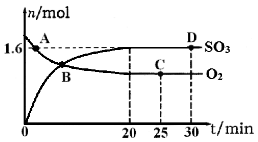
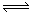 xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是( )
xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是( ) pC(g)+qD(g)已知:平均反应速率v(C)=
pC(g)+qD(g)已知:平均反应速率v(C)= v(A),反应2 min时,A的浓度减少了
v(A),反应2 min时,A的浓度减少了 ,B的物质的量减少了
,B的物质的量减少了 mol,有a mol D生成,回答下列问题:
mol,有a mol D生成,回答下列问题: