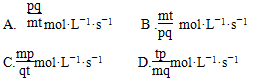题目内容
某温度时,在2 L容器中,某一反应中A、B的物质的量随时间变化的曲线如下图所示,由图中数据分析得:
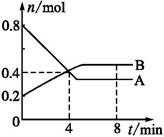
(1)在4 min末时,A、B的物质的量浓度c(A) c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A) Δc(B)(以上填“>”“<”或“=”)。
(2)从反应开始至4 min时,A的平均反应速率为 。
(3)该反应的化学方程式为 。

(1)在4 min末时,A、B的物质的量浓度c(A) c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A) Δc(B)(以上填“>”“<”或“=”)。
(2)从反应开始至4 min时,A的平均反应速率为 。
(3)该反应的化学方程式为 。
(1) = >
(2)0.05 mol·L-1·min-1
(3)2A B
B
(2)0.05 mol·L-1·min-1
(3)2A
 B
B(1)由图可以看出,在4 min末n(A)="n(B)=0.4" mol,又因体积相等,所以c(A)=c(B),从0到4 min内Δc(A)="0.2" mol·L-1,Δc(B)="0.1" mol·L-1。
(2)v(A)="0.05" mol·L-1·min-1。
(3)参加反应的各物质的物质的量之比为n(A)∶n(B)="0.4" mol∶0.2 mol=2∶1。
(2)v(A)="0.05" mol·L-1·min-1。
(3)参加反应的各物质的物质的量之比为n(A)∶n(B)="0.4" mol∶0.2 mol=2∶1。

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)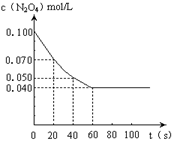
 C(g),经过一段时间后达到平衡。反应过程中测定的部分数据如表,下列说法正确的是
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据如表,下列说法正确的是 CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题: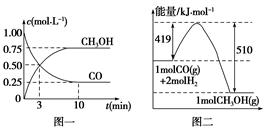
 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中不正确的是( )
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中不正确的是( )
 2XY2
2XY2 2X2Y
2X2Y
 2XY2
2XY2