题目内容
一定条件下,在体积为2L的密闭容器中,3molX和3mol Y发生反应:3X(g)+Y(g)?2Z(g),经60s达到平衡,生成0.4mol Z。下列说法正确的是 ( )
A.60s内反应速率为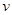 (X)=0.05 mol/(L·s),X的转化率为80% (X)=0.05 mol/(L·s),X的转化率为80% |
B.其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的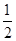 |
| C.其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0 |
| D.其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 |
D
由化学反应方程式可知:
3X(g)+Y(g)?2Z(g)
起始浓度 1.5 1.5 0
变化浓度 0.3 0.1 0.2
平衡浓度 1.2 1.4 0.2
A错,60s内反应速率为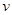 (X)=
(X)=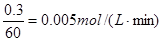
B错,其它条件不变,将容器体积变为4L,相当于减小反应体系的压强;在这个瞬间Z的浓度变为原来的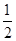 ,随后平衡将向逆反应(气体体积增大)方向移动,再次达到平衡后,Z的浓度会比原来的
,随后平衡将向逆反应(气体体积增大)方向移动,再次达到平衡后,Z的浓度会比原来的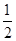 更小。
更小。
C错,其它条件不变,若升高温度,X的体积分数增大,即X的量增多,平衡向逆反应方向移动,即升高温度,平衡向逆反应方向移动,所以该反应的正反应△H<0
D正确,其它条件不变,若初始投入2mol X和2mol Y,相当于压强减小,则物质Y的转化率减小
3X(g)+Y(g)?2Z(g)
起始浓度 1.5 1.5 0
变化浓度 0.3 0.1 0.2
平衡浓度 1.2 1.4 0.2
A错,60s内反应速率为
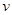 (X)=
(X)=
B错,其它条件不变,将容器体积变为4L,相当于减小反应体系的压强;在这个瞬间Z的浓度变为原来的
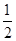 ,随后平衡将向逆反应(气体体积增大)方向移动,再次达到平衡后,Z的浓度会比原来的
,随后平衡将向逆反应(气体体积增大)方向移动,再次达到平衡后,Z的浓度会比原来的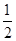 更小。
更小。C错,其它条件不变,若升高温度,X的体积分数增大,即X的量增多,平衡向逆反应方向移动,即升高温度,平衡向逆反应方向移动,所以该反应的正反应△H<0
D正确,其它条件不变,若初始投入2mol X和2mol Y,相当于压强减小,则物质Y的转化率减小

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
 Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
 ;
; 2丙(g),是工业生产中重要反应之一。
2丙(g),是工业生产中重要反应之一。 O2(g) =
O2(g) = 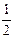 R2O3(s) △H=-834.8 kJ·mol-1
R2O3(s) △H=-834.8 kJ·mol-1
 3B(?)+C(?);开始向容器中冲入A,随着反应的进行,气体平均相对分子质量变小,则下列判断正确的是
3B(?)+C(?);开始向容器中冲入A,随着反应的进行,气体平均相对分子质量变小,则下列判断正确的是
 xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0.5 mol/L,混合气体的总体积为134.4 L(标准状况),C的平均反应速率为0.1 mol/(L·min).试求:
xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0.5 mol/L,混合气体的总体积为134.4 L(标准状况),C的平均反应速率为0.1 mol/(L·min).试求: 2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应达平衡放出的热量为Q1,则
2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应达平衡放出的热量为Q1,则