题目内容
对于平衡体系:mA(气)+nB(气) ≒pC(气)+qD(气) △H <0,下列判断正确的是
A. 若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q
B. 若平衡时,A、B的转化率相等,说明反应开始时A、B的物质的量之比为m:n
C. 若平衡体系共有气体a mol,再向其中加入b molB物质,当重新达到平衡时,气体的总物质的量等于(a+b)mol,则m+n =q+p
D. 温度不变时,若压强增大为原来的2倍,达到新平衡时,总体积一定比原体积的1/2要小
A. 若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q
B. 若平衡时,A、B的转化率相等,说明反应开始时A、B的物质的量之比为m:n
C. 若平衡体系共有气体a mol,再向其中加入b molB物质,当重新达到平衡时,气体的总物质的量等于(a+b)mol,则m+n =q+p
D. 温度不变时,若压强增大为原来的2倍,达到新平衡时,总体积一定比原体积的1/2要小
BC
A、将容器的体积缩小到原来的一半,不考虑平衡移动,此时A的浓度变为原来的2倍,现在A的浓度为原来的2.1倍,说明平衡向着生成A的方向移动了,体积缩小即增大压强,平衡向着气体体积减小的方向进行,所以m+n<p+q,故A错;B、反应开始时,A、B的物质的量之比为m:n,恰好等于方程式的系数值比,这种情况下平衡时,A、B的转化率相等,故B正确;C、若m+n=p+q,则往含有amol气体时建立的平衡和向平衡体系中加入amol的B时建立的平衡等同,所以往含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol,C正确;D、若该反应中,m+n=p+q,温度不变时,压强增大到原来的2倍,达到新平衡时,总体积变为原来的1/2,故D错.故本题选BC.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
 2CO(正反应吸热),反应速率为v1:N2+3H2
2CO(正反应吸热),反应速率为v1:N2+3H2  2C(气) △H﹤0正确的说法是
2C(气) △H﹤0正确的说法是 (X)=0.05 mol/(L·s),X的转化率为80%
(X)=0.05 mol/(L·s),X的转化率为80%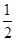
 4NO(g)+6H2O(g)+3623KJ;下列叙述正确的是
4NO(g)+6H2O(g)+3623KJ;下列叙述正确的是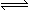 B(气) △H=Q达到平衡时混合气体的平均分子量为M1, t2℃时该反应的平衡混合气体的平均分子量为M2 , 当平衡从t1℃升温至t2℃时,下列说法中正确的是:
B(气) △H=Q达到平衡时混合气体的平均分子量为M1, t2℃时该反应的平衡混合气体的平均分子量为M2 , 当平衡从t1℃升温至t2℃时,下列说法中正确的是: N2O4 △H<0,根据图像判断后填空:
N2O4 △H<0,根据图像判断后填空: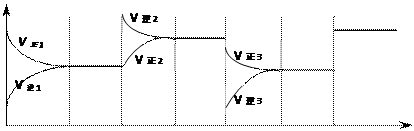 t1 t2 t3 t4 t5 t6 t
t1 t2 t3 t4 t5 t6 t
 pC(g)+qD(g),如图所示是A的转化率同压强、温度的关系,分析图可以得出的正确结论是
pC(g)+qD(g),如图所示是A的转化率同压强、温度的关系,分析图可以得出的正确结论是