题目内容
一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:2X(g)+Y(g)  Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
 Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是| A.60 s时Z的平衡浓度为0.03 mol/L |
| B.将容器容积变为20 L,Z的新平衡浓度将等于原平衡浓度的一半 |
| C.若温度和体积不变,往容器内增加1 mol N2,压强增大,Y的转化率将增大 |
| D.若升高温度,X的体积分数增大,则正反应的△H>0 |
A
2X(g)+Y(g)
 Z(g)
Z(g)起始量(mol) 1 1 0
转化量(mol) 0.6 0.3 0.3
平衡量(mol) 0.4 0.7 0.3
保持温度和体积不变,增加X的浓度,可以提高其它反应物的转化率,但自身转化率会降低。因为反应是体积减小的可逆反应,当容器体积变为20L时,体系内压强降低,平衡向逆反应方向移动,所以Z的新平衡浓度将小于原平衡浓度的1/2。升高温度,X的体积分数增大,说明平衡向逆反应方向移动,因此正反应是放热反应。所以正确的答案是A。

练习册系列答案
 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案
相关题目
 B(g),下列各项中,表示已达到平衡的是:
B(g),下列各项中,表示已达到平衡的是: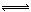 2CO(正反应吸热),反应速率为v1:N2+3H2
2CO(正反应吸热),反应速率为v1:N2+3H2 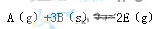 ,正反应放热。为使平衡状态向生成E的方向移动,适宜的条件是①高温、②低温、③高压、④低压、⑤加催化剂、⑥将E
,正反应放热。为使平衡状态向生成E的方向移动,适宜的条件是①高温、②低温、③高压、④低压、⑤加催化剂、⑥将E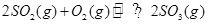 ,从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
,从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是  (X)=0.05 mol/(L·s),X的转化率为80%
(X)=0.05 mol/(L·s),X的转化率为80%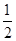
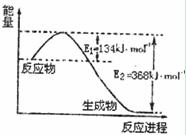
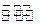 2NH3(g)
2NH3(g) 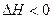
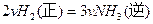

 △H=akJ/mol.
△H=akJ/mol. △H=bkJ/mol,
△H=bkJ/mol,