题目内容
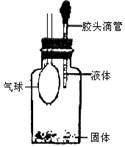
(8分)某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2。该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量O2,该同学推测反应中可能生成了H2O2,并进行实验探究。
(1)写出Na2O2与水反应的化学方程式 。
(2)试设计实验证明溶液X中含过氧化氢 。
(3)通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式: H2O2 + Fe2+ + OH-— Fe(OH)3¯,该反应中H2O2表现了 性(填“氧化”或“还原”)。
(4)已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现了 性(填“氧化”或“还原”)。

(1)写出Na2O2与水反应的化学方程式 。
(2)试设计实验证明溶液X中含过氧化氢 。
(3)通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式: H2O2 + Fe2+ + OH-— Fe(OH)3¯,该反应中H2O2表现了 性(填“氧化”或“还原”)。
(4)已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现了 性(填“氧化”或“还原”)。
(8分)
(1)2 Na2O2 + 2 H2O = 4 NaOH + O2↑(2分)
(2)取溶液X少量于洁净的试管中,加入适量MnO2粉末,用带火星的木条检验,若木条复燃证明有H2O2(2分)
(3)1、2、4、2(2分);氧化性(1分)
(4)还原性(1分)
(1)2 Na2O2 + 2 H2O = 4 NaOH + O2↑(2分)
(2)取溶液X少量于洁净的试管中,加入适量MnO2粉末,用带火星的木条检验,若木条复燃证明有H2O2(2分)
(3)1、2、4、2(2分);氧化性(1分)
(4)还原性(1分)
试题分析:Na2O2与水反应的化学方程式是2 Na2O2 + 2 H2O = 4 NaOH + O2↑;证明溶液X中含过氧化氢的方法是:取溶液X少量于洁净的试管中,加入适量MnO2粉末,用带火星的木条检验,若木条复燃证明有H2O2;通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:1H2O2 +2Fe2+ + 4OH-=2 Fe(OH)3¯,该反应中H2O2表现了氧化性;已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现还原性。2O2与水的反应
点评:有关Na2O2与水的反应的知识来自于教材,此题要结合实验的目的,注意分析实验过程。

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目