题目内容
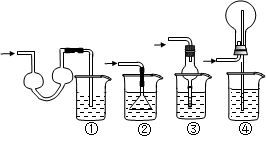
下列制备和收集气体的实验装置合理的是



| A.用氯化铵和氢氧化钙制NH3 | B.用铜片和稀硝酸制NO  |
| C.用锌粒和稀硫酸制H2 | D.用双氧水和二氧化锰制O2 |
D
试题分析:A中的发生装置大试管口要略向下倾斜;NO不能用排空气法收集,它易和氧气反应;氢气要用向下排空气法收集;密度小于空气密度;故选D。
点评:熟悉常见的气体制备和收集方法,此类问题便不难解决。
常见的气体制备和收集方法
氢气:活泼金属与稀酸,向下排空气法
氧气:加热氯酸钾+二氧化锰固体,排水法或者向上排空气法。
氮气:空气通过灼热的铜粉除氧气,然后通入氢氧化钠除二氧化碳,然后用浓硫酸干燥,排水法。
氯气:浓盐酸+高锰酸钾,向上排空气法,排水法(饱和氯化钠溶液)。
二氧化碳:碳酸钙和稀盐酸,向上排空气法。
氯化氢:浓硫酸加氯化钠加热,向上排空气法。
二氧化硫:亚硫酸钠加稀硫酸,向上排空气法,排水法(饱和亚硫酸钠溶液)。
一氧化氮,二氧化氮排水法收集就可以。
二氧化氮:浓硝酸加铜,向上排气法。
氨气:氢氧化钙加氯化铵,加热,向下排空气。
一氧化碳:二氧化碳通过灼热的碳。
甲烷:无水醋酸钠和碱石灰加热,排水法。

练习册系列答案
相关题目