题目内容
【题目】海水是资源宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。完成下列填空:
(1)氯离子原子核外有___种不同运动状态的电子,有___种不同能量的电子,共占据了___个轨道。
(2)溴在周期表中的位置___。HI的稳定性比HBr___(填写“强”或“弱”)。
(3)卤素单质及其化合物在许多性质上都存在递变规律,请说明下列递变规律的原因。
①熔点按F2、Cl2、Br2、I2的顺序依次升高,原因是___。
②还原性按Cl-、Br-、I-的顺序依次增大,原因是___。
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是___,氧化产物___。(填离子符号)
(5)HClO有很好的杀菌消毒效果,为增强氯水的杀菌消毒能力,可用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因___。
【答案】18 5 9 第四周期、ⅦA 弱 F2、Cl2、Br2、I2都是分子晶体,相对分子质量依次增大,分子间作用力依次增强 从Cl-、Br-、I-半径依次增大,失电子的能力依次增强,还原性依次增大 2ClO2+2OH-→ClO2-+ClO3-+H2O ClO3- 氯水中存在Cl2+H2O![]() HCl+HClO,加入小苏打,HCl与之反应导致盐酸浓度减小,上述平衡向正向移动,而次氯酸不能与之反应,所以HClO浓度增大
HCl+HClO,加入小苏打,HCl与之反应导致盐酸浓度减小,上述平衡向正向移动,而次氯酸不能与之反应,所以HClO浓度增大
【解析】
(1)氯离子原子核外有18个电子,其电子排布式为1s22s22p63s23p6,共有18种不同的运动状态,有5种不同能量的电子,共占据9个轨道;
(2)溴的核电荷数为35,在周期表中的位置为第四周期、ⅦA,;Br的非金属性比I强,则HI的稳定性比HBr弱;
(3)①F2、Cl2、Br2、I2的相对分子质量逐渐增大,且都属于分子晶体,单质的相对分子质量越大,则熔点越高;
②元素的非金属性越强,对应的阴离子的还原性越强,非金属性Cl>Br>I,Cl-、Br-、I-半径依次增大,失电子的能力依次增强,还原性依次增大;
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,为氧化还原反应,离子反应为2ClO2+2OH-=ClO2-+ClO3-+H2O,Cl元素失去电子被氧化,则氧化产物为ClO3-;
(5)氯水中存在Cl2+H2O![]() HCl+HClO,HCl和与碳酸氢钠反应,而HClO不反应,加入小苏打,盐酸能与之反应导致盐酸浓度下降,平衡向正向移动,而HClO不能与之反应,所以HClO浓度增大。
HCl+HClO,HCl和与碳酸氢钠反应,而HClO不反应,加入小苏打,盐酸能与之反应导致盐酸浓度下降,平衡向正向移动,而HClO不能与之反应,所以HClO浓度增大。

 名校课堂系列答案
名校课堂系列答案【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),金属性最强的是___,除稀有气体外第三周期中原子半径最小的是____,属于过渡元素的是___(该空格用表中的字母表示)。
(2)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为___。
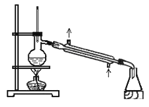
(3)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。

【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则 =18
=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L