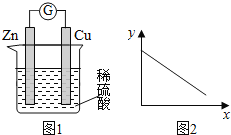
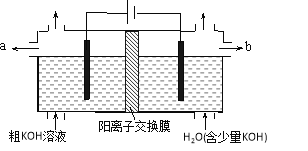
题目内容
【题目】关于实验室中四个装置的说明符合实验要求的是
A.若需制备较多量的乙炔可用此装置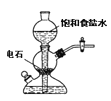
B.可用此装置来制备硝基苯,但产物中可能会混有酸
C.可用此装置来分离含碘的四氯化碳液体,最终在锥型瓶中可获得碘
D.可用此装置来制备乙酸乙酯并在烧瓶中获得产物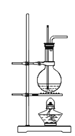
【答案】B
【解析】
A.制取乙炔时电石和水反应放出大量的热,不能用启普发生器,故A错误;
B.该装置可制备硝基苯,其中硝酸是反应物,浓硫酸起催化作用,反应前后质量和化学性质均不发生改变,则产物中可能会混有硫酸,故B正确;
C.分离含碘的四氯化碳液体,四氯化碳沸点低,先蒸馏出来,所以装置可分离,最终在锥形瓶中可获得四氯化碳,故C错误;
D.制备乙酸乙酯不需要测定温度,不能在烧瓶中获得产物,应在制备装置后连接收集产物的装置(试管中加饱和碳酸钠溶液),D错误;
故答案为B。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】I.用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g)![]() N2(g)+CO2(g)。在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
N2(g)+CO2(g)。在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
(1)写出上述反应的平衡常数表达式______。
(2)①结合表中数据,判断该反应的ΔH____0(填“>”或“<”),理由是_____
②判断该反应达到平衡的依据是_____。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)=v逆(N2)
II.结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 |
HClO | 3×10-8 |
H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 |
| <>H2S | K1=1.3×10-7 K2=7.1×10-15 |
请回答下列问题:
(1)同浓度的CH3COO-、![]() 、
、![]() 、
、![]() 、ClO-、S2-中结合H+的能力最弱的是____。
、ClO-、S2-中结合H+的能力最弱的是____。
(2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___(填字母)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)/c(OH-) D.c(OH-)
(3)0.1mol·L-1的H2C2O4溶液与0.1mol·L-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_____。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK___NaClO,两溶液中:c(Na+)-c(ClO-)___c(K+)-c(CH3COO-)(填“>”“<”或“=”)。
(5)向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=____。
【题目】用图所示装置检验乙烯时不需要除杂的是
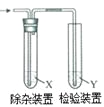
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |