题目内容
下列比较中正确的是
| A.金属性:Mg>Al>Na | B.原子半径:S>O>F |
| C.碱性:KOH>Mg(OH)2>NaOH | D.氢化物的稳定性:HBr>HCl>PH3 |
B
解析试题分析:A、钠、镁、铝都是第三周期元素,原子序数逐渐增大。同周期自左向右金属性逐渐减弱,因此金属性是Na>Mg>Al,A不正确;B、S和O属于同一主族,自上而下原子半径逐渐增大。O和F都是第二周期元素,自左向右原子半径逐渐减小,因此原子半径是S>O>F,B正确;C、金属性越强,最高价氧化物对应水化物的碱性越强。金属性是K>Na>Mg,所以碱性是KOH>NaOH>Mg(OH)2,C不正确;D、非金属性越强,氢化物的稳定性越强。非金属性是Cl>Br>P,所以氢化物的稳定性是HCl>HBr>PH3,D不正确,答案选B。
考点:考查元素周期律的应用

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
下列各组顺序的排列不正确的是
| A.原子半径:Na>Mg>Al>H |
| B.热稳定性: HC l<H2S<PH3 |
| C.酸性强弱:H2SiO3<H2CO3<H3PO4 |
| D.氧化性:K+<Na+<Mg2+<Al3+ |
短周期元素X、Y、Z在元素周期表中的位置如图所示。下列说法正确的是
| A.原子半径的大小为:Z>Y>X |
| B.若X的一种单质为原子晶体,则含Y元素的盐溶液一定呈酸性 |
| C.若Y可作半导体材料,则X、Z的单质均为分子晶体 |
| D.若Y与Z的核电荷数之和为X的4倍,则X、Z各自形成的氢化物熔沸点:X<Z |
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
| A.离子半径的大小顺序为W>Q>Z>X>Y |
| B.元素X的气态氢化物与Q的单质可发生置换反应 |
| C.元素X与Y可以形成5种以上的化合物 |
| D.元素Z、W、Q的单质在一定条件下均能和强碱溶液反应 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
已知X是短周期中最活泼的金属,且与R同周期。下列叙述错误的是
A.离子半径大小:Y2- > M2- > R3+
B.Z与M组成的化合物是形成酸雨的原因之一
C.将YM2通入BaCl2溶液中有大量白色沉淀产生
D.X、Y、R的最高价氧化物的水化物两两之间能发生反应
现有三种元素的基态原子的电子排布式如下:① 1s22s22p63s23p1;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:①>②>③ | D.最高正化合价:③>②>① |
氮化钠和氢化钠与水反应的化学方程式如下:Na3N + 3H2O=3NaOH + NH3,NaH + H2O=NaOH + H2↑。有关Na3N和NaH的叙述正确的是
| A.离子半径:Na+>N3->H+ |
| B.与水反应都是氧化还原反应 |
| C.与盐酸反应都只生成一种盐 |
| D.加热熔化时,都只破坏离子键 |
短周期元素X、Y、Z、W、Q在元素周期表中的位置如图所示。下列说法正确的是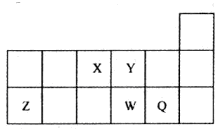
| A.元素W的最高价氧化物对应的水化物的酸性比Q的强 |
| B.原子半径的大小顺序为:X>Y>Z>W>Q |
| C.离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| D.元素Y与元素W的最高化合价的数值等于其族序数 |
在多电子原子中,轨道能量是由以下哪些因素决定( )
①电子层②原子轨道类型(电子亚层)③空间伸展方向④自旋状态
| A.①② | B.①④ | C.②③ | D.③④ |