题目内容
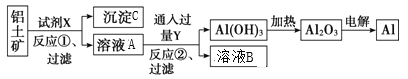
【题目】CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。

根据题意完成下列填空:
(1)理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为___。
(2)实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是___。
(3)请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。____

(4)上述使用的标准氢氧化钠溶液已经通过基准物质的标定。下列物质中通常可用来标定碱液的基准物质是___。
A.醋酸 B.草酸 C.苯甲酸 D.苯酚
【答案】3:2 溶液由无色变成红色(或浅红色),且半分钟内不褪色  BC
BC
【解析】
(1)①在酸性条件下,硝酸盐具有氧化性,能氧化单质铜,反应的离子方程式是3Cu+8H++2NO3═3Cu2++2NO↑+4H2O;根据方程式可知,如果硝酸的物质的量是2mol,则根据氢原子守恒可知,硫酸的物质的量就是(8mol2mol)÷2=3mol,所以硫酸和硝酸的物质的量之比是3:2;
(2)②由于酸不能使酚酞变色,而碱可以使酚酞显红色,所以终点时的现象是加入最后一滴碱液,溶液由无色变成红色(或浅红色),且半分钟内不褪色;
(3)由于随着氢氧化钠溶液的滴加,溶液的pH会逐渐增大,邻近终点时pH会发生突变,所以正确的图象是 ,
,
(4)用来标定碱液的基准物质,酸性要较强,能够使指示剂明显的显色来判断终点,醋酸是一元弱酸,苯酚的酸性更弱,草酸为二元弱酸,苯甲酸是弱酸,但酸性比比脂肪酸强,故醋酸和苯酚不能滴定碱液,答案选BC。

练习册系列答案
相关题目