题目内容
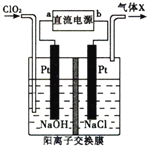
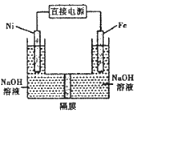
【题目】高铁酸盐在能源环保领域有广泛用途。用镍![]() 、铁作电极电解浓NaOH溶液制备高铁酸盐
、铁作电极电解浓NaOH溶液制备高铁酸盐![]() 的装里如图所示。下列推断合理的是
的装里如图所示。下列推断合理的是
A.镍是阳极,电极反应为![]()
B.电解时电流的方向为:负极![]() 电极
电极![]() 溶液
溶液![]() 电极
电极![]() 正极
正极
C.若隔膜为阴离子交换膜,则![]() 自左向右移动
自左向右移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH升高![]() 假设电解前后体积变化忽略不计
假设电解前后体积变化忽略不计![]()
【答案】C
【解析】
用镍![]() 、铁作电极电解浓NaOH溶液制备高铁酸盐
、铁作电极电解浓NaOH溶液制备高铁酸盐![]() ,铁元素化合价升高,铁失电子发生氧化反应,所以铁为阳极。
,铁元素化合价升高,铁失电子发生氧化反应,所以铁为阳极。
A.铁作电极电解浓NaOH溶液制备高铁酸盐![]() ,铁元素化合价升高,铁失电子发生氧化反应,所以铁为阳极,电极反应为
,铁元素化合价升高,铁失电子发生氧化反应,所以铁为阳极,电极反应为![]() ,故A错误;
,故A错误;
B.电解过程中电子由铁电极流向电源正极,电源负极流向Ni电极,电子不能通过电解质溶液,故B错误;
C、阴离子交换膜只允许阴离子通过;阴离子移向阳极,铁为阳极,所以氢氧根离子应从左向右移动,故C正确;
D.阳极电极反应![]() ,阳极消耗氢氧根离子,溶液PH减小;阴极电极反应
,阳极消耗氢氧根离子,溶液PH减小;阴极电极反应![]() ,氢氧根离子浓度增大,pH升高;依据电子守恒分析,氢氧根离子消耗的多,生成的少,所以混合后溶液pH降低,故D错误;
,氢氧根离子浓度增大,pH升高;依据电子守恒分析,氢氧根离子消耗的多,生成的少,所以混合后溶液pH降低,故D错误;
选C。

【题目】应用酸碱中和滴定原理测定某市售白醋的含量。
I.实验步骤
(I)量取10.00mL食用白醋,稀释到100mL,得到待测白醋溶液,取待测白醋溶液20.00mL于锥形瓶中,向其中滴加几滴________作指示剂。
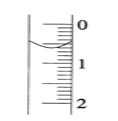
(2)碱式滴定管盛装0.1000mol/LNaOH溶液初始时的液面位置如图所示,此时的读数_____mL。
(3)滴定过程中,滴至_________________时即为滴定终点,记录NaOH溶液的最终读数。重复滴定4次。
Ⅱ.实验记录
实验序号 | 待测白醋溶液体积/mL | 0.1000mol/LNaOH溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20.00 | 0.10 | l5.10 |
2 | 20.00 | 0.00 | 14.95 |
3 | 20.00 | 0.15 | 15.20 |
4 | 20.00 | 1.10 | 17.10 |
Ⅲ.数据处理与讨论
(4)按实验所得数据,可折算得c(市售白醋)=__________mol/L。
(5)在本实验的滴定过程中,下列操作会使实验结果偏大的是________(填选项字母)。
a.碱式滴定管在装液前未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气池,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出