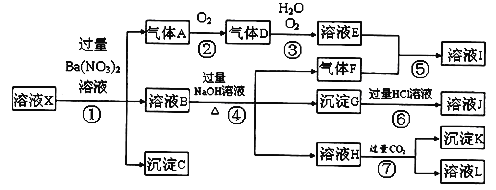
题目内容
【题目】在120℃、1个大气压下,将150mLCH4和He的混合气体中与350mLO2混合,点燃并充分反应。
(1)若恢复到原条件,则混合气体的总体积为mL
(2)若再将以上混合气体干燥,得混合气体450mL。则原混合气体中CH4和He的体积比为
【答案】(1)500(2)1:5
【解析】
试题分析:(1)He与氧气不反应,根据甲烷与氧气反应的方程式CH4+2O2![]() CO2+2H2O可知在120℃时水为气体,反应前后体积不变,则恢复到原条件混合气体的总体积为150mL+350mL=500mL;
CO2+2H2O可知在120℃时水为气体,反应前后体积不变,则恢复到原条件混合气体的总体积为150mL+350mL=500mL;
(2)若再将以上混合气体干燥,得混合气体450mL,这说明减少的50mL应该是水蒸气的体积,因此根据方程式可知甲烷的体积是25mL,所以He的体积是125mL,则原混合气体中CH4和He的体积比为25:125=1:5。

练习册系列答案
相关题目