题目内容
下列溶液中,有关物质的量浓度关系正确的是
A.室温下,向10 mL pH=3.0的醋酸溶液中加入水稀释后,溶液中 将要变小
将要变小
B.pH=8.0的KHS溶液中,c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+)
C.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:2c(OH-)+c (A-)=2c(H+)+c(HA)
D.将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(NH3·H2O)<c(HCl)
A.室温下,向10 mL pH=3.0的醋酸溶液中加入水稀释后,溶液中
 将要变小
将要变小B.pH=8.0的KHS溶液中,c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+)
C.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:2c(OH-)+c (A-)=2c(H+)+c(HA)
D.将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(NH3·H2O)<c(HCl)
C
试题分析:A、醋酸溶液中醋酸的电离常数
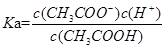 ,水的离子积常数
,水的离子积常数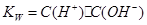 ,
,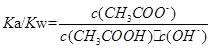 也为常数与浓度无关,错误;B、KHS溶液中,存在HS-
也为常数与浓度无关,错误;B、KHS溶液中,存在HS- S2-+ H+,同时H2O
S2-+ H+,同时H2O H++OH-,故c(S2-)< c(H+),错误;C、根据题意两者的混合溶液相当于等浓度的HA和NaA混合溶液,存在①电荷守恒:H++ Na+ = A-+OH-,②物料守恒2Na+ ="HA+" A-,由①×2-②=2c(OH-)+c (A-)=2c(H+)+c(HA)为质子守恒式,正确;D、假设c(NH3·H2O)=c(HCl),混合后得到NH4Cl溶液,由于NH4+水解溶液显酸性,若要所得溶液呈中性,需NH3·H2O过量,即 c(NH3·H2O)>c(HCl),错误。
H++OH-,故c(S2-)< c(H+),错误;C、根据题意两者的混合溶液相当于等浓度的HA和NaA混合溶液,存在①电荷守恒:H++ Na+ = A-+OH-,②物料守恒2Na+ ="HA+" A-,由①×2-②=2c(OH-)+c (A-)=2c(H+)+c(HA)为质子守恒式,正确;D、假设c(NH3·H2O)=c(HCl),混合后得到NH4Cl溶液,由于NH4+水解溶液显酸性,若要所得溶液呈中性,需NH3·H2O过量,即 c(NH3·H2O)>c(HCl),错误。
练习册系列答案
相关题目

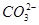 的物质的量浓度相同,则c1和c2的关系是
的物质的量浓度相同,则c1和c2的关系是