题目内容
【题目】甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。
已知
CH3OH(1) + O2(g) = CO(g) + 2H2O(g) △H1 = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) △H2 = -566.0 kJ·mol-1
(1)试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:__________________________________________
(2)甲醇作为燃料,优点是燃烧时排放的污染物少,从而不仅能缓解能源紧张和温室效应的问题,还能改善大气质量。试利用(1)中的热化学方程式计算,完全燃烧16g甲醇,生成二氧化碳和水蒸汽时,放出的热量为_____ kJ ,生成的CO2气体标准状况下体积是______L。
(3)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在______极反应;电极反应式为____________________________________________。
(4)某同学设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。
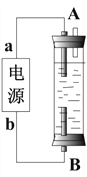
下列说法中正确的是___________(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl 溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
【答案】 2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g) △H =-1453.28kJ·mol-1 363.32 11.2 负 CH3OH + 8OH--6e-= CO32-+ 6H2O B、D
【解析】(1)已知①CH3OH(1) + O2(g) = CO(g) + 2H2O(g) △H1 = -443.64 kJ·mol-1;②2CO (g) + O2(g) = 2CO2(g) △H2 = -566.0 kJ·mol-1。由①![]() ②得2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g),所以△H =(-443.64 kJ·mol-1)
②得2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g),所以△H =(-443.64 kJ·mol-1)![]() +(-566.0 kJ·mol-1)=-1453.28kJ·mol-1,所以CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式为2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g) △H =-1453.28kJ·mol-1 。
+(-566.0 kJ·mol-1)=-1453.28kJ·mol-1,所以CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式为2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g) △H =-1453.28kJ·mol-1 。
(2)由CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式为2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g) △H =-1453.28kJ·mol-1 可知,完全燃烧2mol CH3OH(1) (质量为64g) 放出1453.28kJ的热量,因此,完全燃烧16g甲醇,生成二氧化碳和水蒸汽时,放出的热量为363.32kJ ,生成的CO2气体标准状况下体积是11.2L。
(3)由甲醇和氧气以强碱做电解质溶液的新型手机电池,甲醇在电池反应中做还原剂、发生氧化反应,所以其在负极反应;电极反应式为CH3OH + 8OH--6e-= CO32-+ 6H2O。
(4)由制取Fe(OH)2的实验装置可知,因为A电极附近有空气可以把氢氧化亚铁氧化,所以,A必须做阴极(阴极发生的反应是2H+ + 2e-= H2↑)、B做阳极(铁做阳极,铁变为亚铁离子),才能保证溶液中产生大量的白色沉淀保持较长时间不变色。A.电源中的a一定为负极,b一定为正极,A不正确;B.可以用NaCl 溶液作为电解液,B正确;C.阳极B必须用铁作电极,阴极无所谓,C不正确;D.阴极发生的反应是2H+ + 2e-= H2↑,可以把阴极附近的空气排走,保护氢氧化亚铁,D正确。综上所述,说法中正确的是B、D。

【题目】下表各组物质之间通过一步反应不能实现如图所示转化的是( )

选项 | a | b | c |
A | Si | SiO2 | H2SiO3 |
B | SO2 | SO3 | H2SO4 |
C | NaOH | Na2CO3 | Na2SO4 |
D | NO | NO2 | HNO3 |
A. A B. B C. C D. D
【题目】用如图装置来分离CO2和CO混合气体并干燥,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为()
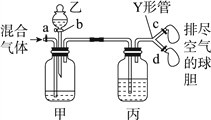
甲 | 乙 | 丙 | |
A | 饱和NaHCO3溶液 | 12 mol·L-1盐酸 | 18.4 mol·L-1 H2SO4 |
B | 饱和Na2CO3溶液 | 2 mol·L-1 H2SO4 | 饱和NaOH溶液 |
C | 饱和NaOH溶液 | 2 mol·L-1 H2SO4 | 18.4 mol·L-1 H2SO4 |
D | 18.4 mol·L-1 H2SO4 | 饱和NaOH溶液 | 18.4 mol·L-1 H2SO4 |
A. A B. B C. C D. D
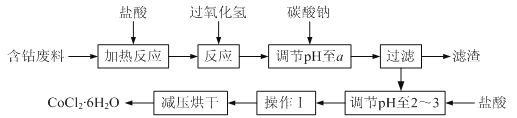
【题目】CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
已知:①CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,易失去结晶水变成有毒的无水氯化钴。(乙醚:无色液体,沸点34.5℃,在水中的溶解度小)
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
请回答下列问题:
(1)钴的性质与铁相似,能与盐酸和硝酸反应,写出钴与盐酸反应的化学方程式:________________________________。
(2)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点:
①为__________________________,防止大气污染;
②防止产品中混有硝酸盐。
(3) 加入碳酸钠调节pH至a,a的范围应是5.2~_________。
(4) 操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和_________。
(5)根据表中数据,判断Ksp[Fe(OH)3] ________Ksp[Co(OH)2] (填“<”、“=”或“>”) 。在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是:将产品溶于乙醚过滤后,再蒸馏。