题目内容
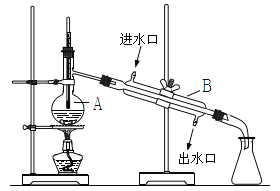
【题目】有一硝酸盐晶体,其化学式为M(NO3)xnH2O,相对分子质量为242g/mol, 取1.21g该晶体溶于水,配成100mL溶液,将此溶液倒入下图所示装置中,用石墨作电极进行电解,当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出。在A极得到金属0.32g.下列说法正确的是( )

A. 金属M的摩尔质量为64 B. x=4
C. n=3 D. C极发生还原反应
【答案】C
【解析】有一硝酸盐晶体,其化学式表示为M(NO3)xnH2O经测定其摩尔质量为242gmol-1。1.21g该晶体的物质的量=![]() =0.005mol;溶于水配成100mL溶液,将此溶液倒入如图所示装置中,用石墨作电极进行电解,当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g,A极为阴极;设M的相对原子质量为y,析出的金属电极反应为:
=0.005mol;溶于水配成100mL溶液,将此溶液倒入如图所示装置中,用石墨作电极进行电解,当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g,A极为阴极;设M的相对原子质量为y,析出的金属电极反应为:
Mx+ + xe- ═ M
1 x y
0.005mol0.01mol 0.32g
计算得到y=64g/mol;x=2;M(NO3)xnH2O的摩尔质量为242gmol-1,则64+62×2+18n=242,n=3;A.根据上述分析,金属M的摩尔质量为64 g/mol,故A错误;B. 根据上述分析,x=2,故B错误;C. 根据上述分析, n=3,故C正确;D. A极为阴极,C为负极,原电池的负极发生氧化反应,故D错误;故选C。

练习册系列答案
相关题目