题目内容
【题目】现有A、B、C、D、E五种物质,并存在如下转化关系,其中E为黑色粉末。

I、利用右图所示的实验装置进行C与水的反应,回答下列有关问题:

(1)在实验前首先___________如何操作___________将分液漏斗中的水滴入试管,然后:
①在导管口处进行适当操作,观察现象。
②观察烧杯中的现象为:___________。根据所观察现象可得到的两个结论是______、_____。
③写出试管中反应的化学方程式_____________。
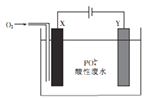
(2)已知水与C反应生成D及另一种化合物F,在通常状况下,足量F的稀溶液与含溶质为1mol的稀盐酸完全反应时放出akJ的热量,请写出该反应的热化学方程式_______。
II.在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X。为检验X的性质,设计如下图所示实验装置:

(1)请写出此实验中制备单质气体X的离子反应方程式___________。
(2)实验过程中,观察到装置III中品红试纸的红色褪去,并未观察到“无明显变化”这一预期现象。为了达到这一预期现象,你认为应该如何改进?___________。
(3)实验结束后,装置IV中可观察到现象是_________,若滴加两滴胶头滴管中的试剂,观察到溶液呈红色,胶头滴管中的试剂为:__________。
【答案】 检查装置的气密性 关闭分液漏斗的活塞,出气导管再按一导管,放入水槽液面下,用手捂大试管,若水槽中产生气泡,松开手导管中形成水柱,说明装置气密性良好 出现浑浊(或“产生白色沉淀”) 反应放热 有氧气生成 2Na2O2+2H2O=4NaOH+O2 ↑ NaOH (aq) +HC1(aq) = NaCl (aq) + H2O (l) △H=-akJ/mo1或H+ (aq) + OH-(aq) = H2O (1) △H=-akJ/mol MnO2+4H++2Cl- = Mn2++Cl2↑+2H2O 在装置II、III之间加入一个盛有浓硫酸的洗气瓶 溶液由浅绿色变为黄色 KSCN (合理答案即可)
【解析】E为黑色粉末,图中转化中均作催化剂,利用氯酸钾、过氧化氢在二氧化锰作催化剂条件下制备氧气,可推知固体A为KClO3、B为H2O2,E为MnO2,D为O2,淡黄色固体C能与水反应,C应为Na2O2。
I、(1)在实验前首先检查装置的气密性,关闭分液漏斗的活塞,出气导管再按一导管,放入水槽液面下,用手捂大试管,若水槽中产生气泡,松开手导管中形成水柱,说明装置气密性良好。②烧杯中的现象为:出现浑浊(或“产生白色沉淀”),过氧化钠与水反应生成氢氧化钠与氧气,反应放热,氢氧化钙的溶解度随温度升高而降低。根据所观察现象可得到的两个结论是反应放热、有氧气生成。③试管中反应的化学方程式 2Na2O2+2H2O=4NaOH+O2↑ 。(2)水与C过氧化钠反应生成D氧气及另一种化合物F氢氧化钠,在通常状况下,足量F氢氧化钠的稀溶液与含溶质为1mol的稀盐酸完全反应时放出akJ的热量,该反应的热化学方程式NaOH(aq)+HC1(aq)=NaCl(aq)+H2O(l) △H=-akJ/mo1或H+(aq)+OH-(aq)=H2O(1) △H=-akJ/mol;II.在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X,则无氧酸为HCl、X为Cl2,(1)实验中制备单质气体X的离子反应方程式MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O。(2)实验过程中,观察到装置III中品红试纸的红色褪去,并未观察到“无明显变化”这一预期现象。为了达到这一预期现象,加入装置Ⅲ中的氯气应干燥,应在装置II、Ⅲ之间加入一个盛有浓硫酸的洗气瓶;(3)氯气氧化亚铁离子生成铁离子,装置Ⅳ中可观察到溶液由浅绿色变为黄色;滴加试剂,观察到溶液呈血红色,应滴加KSCN溶液。