题目内容
【题目】研究钠、铁、铜及其化合物具有重要意义。
(1)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐渐加入的0.1mol/L盐酸,产生的气体CO2体积(标准状况下) 与所加入的盐酸的体积之间的关系如图所示:
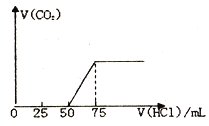
试计算:
(1)向NaOH 溶液中通入CO2气体后,所得溶液中的溶质是_______,反应产生的CO2气体体积(标准状况) 是_______L。
(2)向Ba (OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀为止,写出发生反应的离子方程式_______________,若在上述反应后溶液中继续滴加NaHSO4溶液,写出此步反应的离子方程式: _______________ 。
(3)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。某厂废弃液中,含有2%~5%的NaNO2 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是_____。
A.KMnO4 B.NH4Cl C.O2 D.HNO3
(4)向含Fe(NO3)3、 Cu(NO3)2、HNO3 的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示。
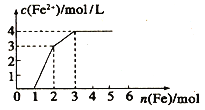
①横坐标0~1段反应的离子方程式为:_____________。
②忽略溶液体积的变化,则原溶液Cu(NO3)2的浓度为_____________。
【答案】 NaOH和Na2CO3 0.056L Ba2++OH-+H++SO42-=BaSO4↓+H2O OH-+H+=H2O B Fe+NO3-+4H+=Fe3++NO↑+2H2O 1mol/L
【解析】(1)图中生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1;根据反应NaHCO3+HCl= NaCl+CO2↑+H2O可知n(CO2)=n(HCl)= 0.1mol/L×0.025L=0.0025mol,V(CO2)= 0.0025mol×22.4L/mol=0.056L;(2)向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀为止,以硫酸根离子与钡离子按1:1进行反应,发生反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O,若在上述反应后溶液中继续滴加NaHSO4溶液,溶液中未反应的氢氧根离子继续与NaHSO4电离出的氢离子反应,反应的离子方程式为:OH-+H+=H2O;(3)含有2%~5%的NaNO2的溶液直接排放会造成污染,若试剂能使NaNO2转化为不引起二次污染的N2,则物质应该有还原性,加入的物质是NH4Cl,选项是B;
(4)Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液氧化性为HNO3>Fe3+>Cu2+,金属铁先和氧化性强的离子反应。①横坐标0~1段是金属铁和硝酸之间的反应,发生反应的离子方程式为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,所以亚铁离子的浓度不变;②0~1:开始阶段是金属铁和硝酸之间的反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,当加入金属铁1mol是,生成三价铁离子是1mol,所以亚铁离子的浓度不变;1~2:金属铁和硝酸反应结束后,生成1mol的三价铁离子,然后发生反应Fe+2Fe3+=3Fe2+,此时加入的1mol铁会和三价铁反应生成3mol亚铁离子,此时c(Fe2+)=3mol/L,说明溶液的体积为1L;2~3:反应的最后阶段为:Fe+Cu2+=Fe2++Cu,所有的离子均被还原,此时加入的1mol铁会和Cu2+反应生成1mol亚铁离子;则n(Cu2+)=1mol;c(Cu2+)=![]() =1mol/L。
=1mol/L。

 阅读快车系列答案
阅读快车系列答案