题目内容
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛,请回答下列问题:
(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)(填“=”、“>”或“<”)NH4HSO4中c(NH4+).
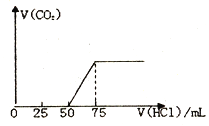
(2)如图一是0.1molL﹣1电解质溶液的pH随温度变化的图象. 
①其中符合0.1molL﹣1 NH4Al(SO4)2的pH随温度变化的曲线是(填写字母);
②室温时,0.1molL﹣1 NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=
molL﹣1(填数值)
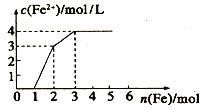
(3)室温时,向100mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图二所示.试分析图中a、b、c、d四个点,水的电离程度最大的是;在c点,溶液中各离子浓度由大到小的排列顺序是 . 
【答案】
(1)>
(2)I;10﹣3
(3)a;c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)>c(H+)
【解析】解:(1)NH4Al(SO4)2水解显酸性,NH4HSO4主要是因为完全电离出的H+显酸性,故pH相同的NH4Al(SO4)2的浓度须远大于大于NH4HSO4溶液的浓度,则NH4Al(SO4)2中c(NH4+) 大于NH4HSO4中c(NH4+),所以答案是:>;(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为I,所以答案是:I;②根据电荷守恒,可以求出2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=c(H+)﹣c(OH﹣)=10﹣3 molL﹣1[c(OH﹣)太小,可忽略],所以答案是:10﹣3;(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+ , 溶液中只有(NH4)2SO4与Na2SO4 , (NH4)2SO4的水解对水的电离有促进作用;而b、c、d三点溶液均含有NH3H2O,而NH3H2O抑制水的电离,故a点溶液中水的电离程度最大;c点溶液呈碱性,即溶液含有(NH4)2SO4、Na2SO4、NH3H2O三种成分,b点时c(Na+)>c(SO42﹣),根据N元素与S元素的关系,可以得出c(SO42﹣)>c(NH4+),故c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)>c(H+),所以答案是:a;c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)>c(H+).

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】下列有关反应热的叙述中正确的是( ) ①已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1 , 则氢气的燃烧热为△H=﹣241.8kJmol﹣1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④已知:
共价键 | C﹣C | C═C | C﹣H | H﹣H |
键能/(kJmol﹣1) | 348 | 610 | 413 | 436 |
上表数据可以计算出 ![]() (g)+3H2(g)→
(g)+3H2(g)→ ![]() (g)的反应热;
(g)的反应热;
⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
A.①②③④
B.③④⑤
C.④⑤
D.⑥