题目内容
【题目】硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:2SO2(g)+O2(g) ![]() 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是________。
压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2mol SO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
(3)某温度下, SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。

2.0 molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”), B点的化学平衡常数是______。
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2, t1时刻达到平衡,测得容器中含SO30.18mol。

①tl 时刻达到平衡后,改变一个条件使化学反应速率发生如下图所示的变化,则改变的条件是________。
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10molO2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”) ,再次达到平衡后,n(SO3)的取值范围是_____________。
【答案】400℃和1个大气压 AC = 800 C 向正反应方向 0.36mol<n(SO3)< 0.4mol
【解析】
(1)因为SO2与O2的反应是放热反应,所以选择的温度为400℃,而1个标准大气压时SO2的转化率已经很大,再增大压强,SO2的转化率提高不大,但会增加生产成本,所以选择1个标准大气压,故答案为:400℃,1个标准大气压;
(2)A、保持温度和容器体积不变,O2的浓度增大,平衡正向移动,SO2的浓度减小,所以A正确;
B、保持温度和容器内压强不变,充入2mol SO3(g)相当于充入2.0molSO2和5.0molO2,新的平衡与原平衡等效,SO2的浓度不变,所以B错误;
C、降低温度,平衡向放热的方向移动,而正反应为放热,所以平衡正向移动,SO2的浓度减小,所以C正确;
D、在其他条件不变时,减小容器的容积,SO2的浓度瞬间增大,之后平衡向气体体积减少的方向移动,即向正反应方向移动,SO2的浓度减小,再次到达平衡时SO2的浓度仍比原来大,所以D错误。
故答案为:AC;
(3)平衡常数只受温度的影响,温度不变,则压强改变,平衡状态由A变到B时,则K(A)=K(B),由图象知,体系总压强为0.10MPa时SO2的平衡转化率为0.8,则二氧化硫转化物质的量=2.0mol×0.8=1.6mol,则依据题意建立如下三段式:
2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
起始:2.0mol 1.0mo 0
转化:1.6mol 0.8mol 1.6mol
平衡:0.4mol 0.2mol 1.6mol
则平衡时c(SO2)=0.04mol/L,c(O2)=0.02mol/L,c(SO3)=0.16mol/L,K(A)=K(B)=c2(SO3)/ c2(SO2)c(O2)=(0.16mol/L)2/(0.04mol/L)2×0.02mol/L=800,故答案为:=,800;
(4)①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化分析可知,改变条件正逆反应速率都增大,且正反应速率大于逆反应速率。
A.体积不变,向容器中通入少量O2,此时刻正反应速率增大,逆反应速率不变,随反应进行正反应速率减小,逆反应速率增大,最后达到新的平衡状态,图象中逆反应速率变化不符合,故A错误;
B.体积不变,向容器中通入少量SO2,此时刻正反应速率增大,逆反应速率不变,随反应进行正反应速率减小,逆反应速率增大,最后达到新的平衡状态,图象中逆反应速率变化不符合,故B错误;
C.缩小容器体积,压强增大,正逆反应速率增大,正反应是气体体积减小的反应,所以平衡正向进行,图象变化符合要求,故C正确;
D.正反应是放热反应,升高温度,平衡逆向进行,正逆反应速率都增大,逆反应速率大于正反应速率,故D错误;
E.体积不变,向容器中通入少量氮气,总压增大,各气体分压不变,平衡不变,故E错误;
故选C;
②当生成0.18molSO3时,参加反应的氧气的物质的量为x,依据题意建立如下关系:
2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
1 2
x 0.18mol
x=0.18mol×1/2=0.09mol,继续通入0.20mol SO2和0.10mol O2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;假设平衡不移动,此时n(SO3)=0.18×2=0.36mol,假设0.40molSO2完全生成SO3,根据反应方程式2SO2(g)+O2(g)2SO3(g)可知,n(SO3)=0.4mol,所以再次达到平衡时,0.36mol<n(SO3)<0.40mol,故答案为:向正反应方向;0.36mol<n(SO3)<0.40mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】锡是大名鼎鼎的“五金”——金、银、铜、铁、锡之一,早在远古时代,人们便发现并使用了锡。回答下列问题:
(1)锡是50号元素,在元素周期表中位于________区。
(2)SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子的空间构型为________。
(3)比较下列卤化锡的熔点和沸点,分析其变化规律及原因____________________________________
SnCl4 | SnBr4 | SnI4 | |
熔点/℃ | -33 | 31 | 144.5 |
沸点/℃ | 114.1 | 202 | 364 |
(4)汽车废气中常含有有毒的一氧化碳气体,但在二氧化锡的催化下,在300 ℃时,一氧化碳可大部分转化为二氧化碳。C、O、Sn电负性由大至小的顺序是__________________________________________。
(5)灰锡具有金刚石型结构,其中Sn原子的杂化方式为________,微粒之间存在的作用力是__________________________________。
(6)①原子坐标参数,表示晶胞内部各原子的相对位置,如图为灰锡的晶胞,其中原子坐标参数A为(0,0,0),B为(1/2,0/1/2),则D为(1/4,___ ,___ )。锡的配位数为________。
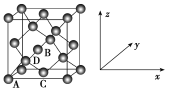
②已知灰锡的晶胞参数a=0.648 9 nm,其密度为______ g·cm-3(NA为6.02×1023 mol-1,不必算出结果,写出简化后的计算式即可)。