题目内容
【题目】实验室以电镀废渣(Cr2O3、CuO、Fe2O3及CaO)为原料制取铜粉和K2Cr2O7的主要流程如图:
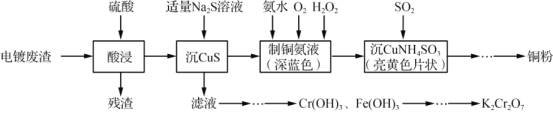
(1)“酸浸”时,所得残渣的主要成分是___________。
(2)“沉 CuS”时,加入的硫化钠必须适量,若过量可能产生的后果是_________(用离子方程式表示)。
(3)一水合硫酸四氨合铜加热到650℃可分解为铜、氨气、二氧化硫和水以及一种无污染气体,写出其化学方程式___________。
(4)“沉CuNH4 SO3”时可用如图装置(夹持、加热仪器略):
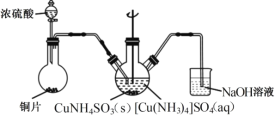
①“沉CuNH4SO3”时,反应液需控制在45℃,合适的加热方式是____________。
②NaOH溶液的作用是___________。
(5)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.0g配成250 mL溶液,用移液管取出25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·L–1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr2O72-被还原为Cr3+)
①若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品K2Cr2O7的纯度为_____%。[已知M(K2Cr2O7)=294g·mol-1,计算结果保留至小数点后两位]。
②上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外,还含有一定浓度的 Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)=2×10–5 mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全?____________(通过计算说明原因)。{已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}
【答案】CaSO4 Fe3++S2–==2Fe2++S↓、Fe2++S2-=FeS↓ 3[Cu(NH3)4]SO4·H2O![]() 3Cu+2N2↑+8NH3↑+3SO2↑+9H2O↑ 45℃的水浴加热 吸收SO2,防止污染空气 61.25% Cr(OH)3开始出现沉淀时,溶液中
3Cu+2N2↑+8NH3↑+3SO2↑+9H2O↑ 45℃的水浴加热 吸收SO2,防止污染空气 61.25% Cr(OH)3开始出现沉淀时,溶液中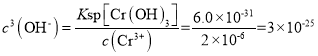 ,Fe3+沉淀完全,c(Fe3+)应小于10-5mol/L,Fe(OH)3沉淀完全时,溶液中
,Fe3+沉淀完全,c(Fe3+)应小于10-5mol/L,Fe(OH)3沉淀完全时,溶液中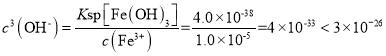 ,说明Fe3+沉淀完全
,说明Fe3+沉淀完全
【解析】
分析流程图,电镀废渣用硫酸酸浸,残渣为与硫酸反应后的难溶物或微溶物,结合电镀废渣的成分可分析出残渣主要成分。向滤液中加入适量硫化钠溶液,进行沉CuS,可知主要发生Cu2++S2-=CuS↓的反应,过滤后滤液和滤渣经不同方式处理。滤液中主要含有Fe3+和Cr3+,经一系列处理,将Fe3+和Cr3+转化为Cr(OH)3和Fe(OH)3,结合题意,根据二者的溶度积的差异,除去Fe(OH)3,Cr(OH)3经过一系列变化最终得到K2Cr2O7。向滤渣中加入氨水、O2和H2O2,制深蓝色的铜氨液,后向铜氨液中加入SO2得到亮黄色片状的沉CuNH4 SO3,最终经一系列变化得到铜粉。据此进行分析。
(1)电镀废渣(Cr2O3、CuO、Fe2O3及CaO)用硫酸酸浸,残渣为CaSO4等溶解度不大的物质;答案为:CaSO4;
(2)溶液中有Cr3+、Cu2+、Fe3+,加适量Na2S溶液,过滤后,滤液中含有Cr3+、Fe3+,经处理后生成Fe(OH)3、Cr(OH)3。若Na2S溶液过量,可能发生2Fe3++S2-=2Fe2++S↓,再过量,S2-和Fe2+继续产生沉淀FeS,发生的反应为:Fe2++S2-=FeS↓;答案为:Fe3++S2–==2Fe2++S↓、Fe2++S2-=FeS↓;
(3根据题给信息以及原子守恒可写出该化学反应方程式为:3[Cu(NH3)4]SO4·H2O![]() 3Cu+2N2↑+8NH3↑+3SO2↑+9H2O↑;答案为:3[Cu(NH3)4]SO4·H2O
3Cu+2N2↑+8NH3↑+3SO2↑+9H2O↑;答案为:3[Cu(NH3)4]SO4·H2O![]() 3Cu+2N2↑+8NH3↑+3SO2↑+9H2O↑;
3Cu+2N2↑+8NH3↑+3SO2↑+9H2O↑;
(4)①要控制100℃以下的加热温度,且受热均匀,可选用水浴加热,沉CuNH4SO3时,反应需控制在45℃,则合适的加热方式为:45℃的水浴加热;答案为:45℃的水浴加热;
②二氧化硫污染空气,必须吸收,故NaOH溶液的作用是吸收SO2,防止其污染空气;答案为:吸收SO2,防止污染空气;
(5)①Cr2O72-作氧化剂,把Fe2+氧化成Fe3+,+6价Cr被还原成Cr3+,反应的离子方程式为:Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O,根据离子反应方程式得:K2Cr2O7的纯度=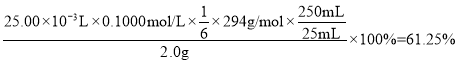 ;答案为:61.25%;
;答案为:61.25%;
②当溶液中Cr(OH)3开始出现沉淀时,溶液中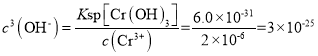 ,Fe3+沉淀完全,c(Fe3+)应小于10-5mol/L,Fe(OH)3沉淀完全时,溶液中
,Fe3+沉淀完全,c(Fe3+)应小于10-5mol/L,Fe(OH)3沉淀完全时,溶液中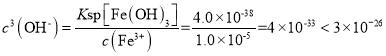 ,说明Fe3+沉淀完全。
,说明Fe3+沉淀完全。

 新思维寒假作业系列答案
新思维寒假作业系列答案