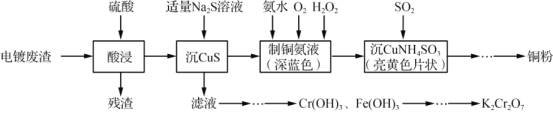
题目内容
【题目】铁、钴、镍及化合物在机械制造、磁性材料、新型电池或高效催化剂等许多领域都有着广泛的应用。请回答下列问题:
(1)基态Ni原子核外的最高能层符号是______,基态Ni2+最外层电子排布式为_______,未成对电子数为________________。
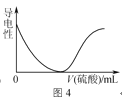
(2)[Co(NO![]() )4]2–中各元素的第一电离能由小到大的顺序为______(填元素符号),配体中N的杂化方式为______________。
)4]2–中各元素的第一电离能由小到大的顺序为______(填元素符号),配体中N的杂化方式为______________。
(3)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如图所示:
①上述三种晶体的晶胞中属于体心立方晶胞的是______(填“α”“δ”或“γ”)-Fe。
②γ-Fe晶胞中铁原子的配位数为_______________。
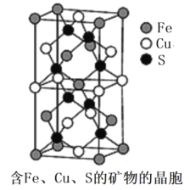
(4)一种含有Fe、Cu、S 三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为Apm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________g/cm3(写出表达式)。
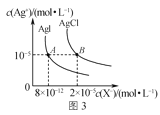
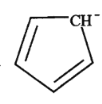
(5)二茂铁[(C5H5)2Fe]可用作火箭燃料添加剂、汽油抗爆剂。二茂铁熔点172℃,沸点249℃,易升华,难溶于水,易溶于有机溶剂,它属于__________晶体。分子中的大π键可用符号![]() 表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H
表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H![]() )结构如图所示,其中的大π键可以表示为_______。
)结构如图所示,其中的大π键可以表示为_______。
【答案】N 3s23p63d8 2 Co、O、N sp2杂化 δ 12 FeCuS2(或CuFeS2) ![]() 或
或![]() 分子
分子 ![]()
【解析】
(1)根据元素符号,判断元素原子的核外电子数,根据构造原理写出该元素离子的最外层电子排布式。
(2)根据电离能的变化规律进行判断,但不要忘记特殊情况。
(3)分析晶体结构,结合常见的晶体结构模型进行分析判断。
(4)利用均摊法计算晶胞拥有的粒子数目,根据公式![]() 求算晶胞的密度。
求算晶胞的密度。
(5)根据晶体的特征性质判断晶体类型。分析环戊二烯负离子,碳原子均与3个原子相邻,故均取sp2杂化,杂化轨道互相重叠,形成分子的σ键,使所有原子处于同一个平面,每个碳原子还有一个未参与杂化的p轨道,垂直于分子平面,每个p轨道里有一个电子,再加上该体系带有一个单位负电荷,具备了形成大π键的条件,据题意可表示出该符号。
(1)Ni是30号元素,核外电子排布式为:1s22s22p63s23p63d84s2,最高能层的符号为:N;基态失去最外层两个电子变为Ni2+,基态Ni2+最外层电子排布式为:3s23p63d8;未成对电子数为2;答案为:N;3s23p63d8;2;
(2)一般情况下非金属性越强第一电离能就越大,但由于N原子中最外层为半充满状态,比较稳定,故第一电离能大于O,所以第一电离能由小到大的顺序为:Co、O、N;NO3-中价层电子对数为![]() ,故为sp2杂化;答案为:Co、O、N;sp2杂化;
,故为sp2杂化;答案为:Co、O、N;sp2杂化;
(3)①根据晶胞结构图,三种晶体的晶胞中属于体心立方晶胞的是δ;答案为:δ;
②γ-Fe晶体晶胞类型为面心立方,位于顶点的Fe原子,被晶胞的三个平面共有,每个平面与其距离相等的Fe原子数目为4,则共有![]() ,故配位数为12;答案为:12;
,故配位数为12;答案为:12;
(4)根据均摊法可知,1个晶胞中含Cu原子个数为:![]() ,Fe原子数为:
,Fe原子数为:![]() ,S原子数为:8,故此矿物的化学式为:FeCuS2(或CuFeS2);晶胞体积为
,S原子数为:8,故此矿物的化学式为:FeCuS2(或CuFeS2);晶胞体积为![]() ,1个晶胞的质量为
,1个晶胞的质量为![]() ,则密度
,则密度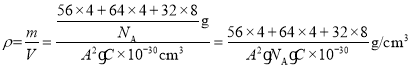 或
或![]() ,答案为:FeCuS2(或CuFeS2);
,答案为:FeCuS2(或CuFeS2);![]() 或
或![]() ;
;
(5)二茂铁晶体熔沸点不高,易升华,易溶于有机溶剂,符合分子晶体特征,所以该晶体为分子晶体;由环戊二烯负离子(C5H5–)结构图可知,环戊二烯负离子,由两个双键和一个负电荷组成环状共轭体系,π电子数是6,即形成5个碳原子、6个π电子的大π键,符号为![]() ;答案为:分子;
;答案为:分子;![]() 。
。