题目内容
【题目】室温下,向200mL 0.1 molL-1CH3COONa溶液中,逐渐加入0.1 molL-1盐酸(不考虑挥发),CH3COOH、CH3COO-物质的量随加入盐酸体积的变化关系如图所示,下列说法正确的是

A. 随着盐酸加入,溶液中水的电离程度逐渐增大。
B. 随着盐酸加入,  逐渐增大。
逐渐增大。
C. M 点,n(H+)-n(OH-)=(a×10-4-0.01)mol
D. 当 V(盐酸)=200mL时,c(CH3COO-)+c(CH3COOH)>c(Cl-)
【答案】C
【解析】A.CH3COO-水解促进水的电离,CH3COOH电离出氢离子抑制水的电离,原溶液为醋酸钠溶液,醋酸根离子水解促进水的电离,随着盐酸的加入,生成的醋酸电离的氢离子抑制水的电离,所以溶液中水的电离程度逐渐减小,故A错误;B.温度不变,水解常数Kh=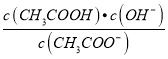 不变,随着HCl的加入,CH3COOH浓度逐渐增大,所以
不变,随着HCl的加入,CH3COOH浓度逐渐增大,所以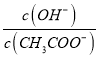 不断减小,故B错误;C.在M点时,溶液中存在电荷守恒为n(Na+)+n(H+)=n(Cl-)+n(CHCOO-)+n(OH-),同时n(CHCOO-)= n(CHCOOH)=0.01mol,则n(H+)-n(OH-)=n(Cl-)+n(CHCOO-)-n(Na+)=a×0.1×10-3+0.01-0.02=(a×10-4-0.01)mol ,故C正确;D.当 V(盐酸)=200mL时,CH3COONa与HCl恰好反应生成等浓度的NaCl和CH3COOH,根据物料守恒,c(CH3COO-)+c(CH3COOH)=c(Cl-),故D错误;故选C。
不断减小,故B错误;C.在M点时,溶液中存在电荷守恒为n(Na+)+n(H+)=n(Cl-)+n(CHCOO-)+n(OH-),同时n(CHCOO-)= n(CHCOOH)=0.01mol,则n(H+)-n(OH-)=n(Cl-)+n(CHCOO-)-n(Na+)=a×0.1×10-3+0.01-0.02=(a×10-4-0.01)mol ,故C正确;D.当 V(盐酸)=200mL时,CH3COONa与HCl恰好反应生成等浓度的NaCl和CH3COOH,根据物料守恒,c(CH3COO-)+c(CH3COOH)=c(Cl-),故D错误;故选C。

练习册系列答案
相关题目






