��Ŀ����
����Ŀ��̼����Ԫ�صĵ��ʼ��仯�����ǹ�����Ȼ�����Ҫ���ʣ�
��1������������л��ʵ���ҿ�ͨ�����з�Ӧ��ȡ��
CH3COONa+NaOH![]() CH4��+X������ƽ��
CH4��+X������ƽ��
��X���� ���壨������ͣ���
��MgO������۵��CaO�ߣ���Ҫԭ���� ��
��2��C60�����ʯ��ʯī��������Ҫ��̼���ʣ��ṹģ�ͷֱ���ͼ��ʾ������ʯī����ʾ�����е�һ��ṹ����

�ٽ��ʯ��̼ԭ�ӵ��ӻ���ʽΪ ��
��ʯī��״�ṹ�У�ƽ��ÿ����������ռ�е�C��C������ ����
���𰸡���1�������ӣ���Mg2+�뾶��Ca2+С�����MgO����ľ����ܽϴ��۵�ϸߣ�
��2����sp3����3��
��������
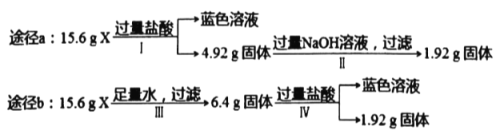
�����������1���ٸ���ԭ���غ��ж�X���ʣ�����X�Ĺ�����ȷ���侧�����ͣ�
����ͬ���͵����Ӿ����У�������۵��뾧���ܳ����ȣ������������Ӱ뾶�ɷ��ȣ�
��2���ٸ��ݼ۲���ӶԻ�������ȷ�����ӻ����ͣ�
�����þ�̯�����㣮
�⣺��1���ٸ���Ԫ���غ㼰ԭ���غ�֪��X��̼���ƣ�̼���������������ӹ��ɵ����Ӿ��壻
�ʴ�Ϊ�����ӣ�
��MgO������۵��CaO�߶��������Ӿ��壬Mg2+�뾶��Ca2+С�����ܽϴ���������þ����ľ����ܴ��������ƣ���������þ������۵���������ƣ��ʴ�Ϊ��Mg2+�뾶��Ca2+С�����MgO����ľ����ܽϴ��۵�ϸߣ�
��2���ٽ��ʯ��ÿ��̼ԭ�Ӻ�4��̼ԭ���ԦҼ����ϣ���û�й¶Ե��ӣ�����ÿ��̼ԭ�ӵļ۲���Ӷ���4����̼ԭ�Ӳ�ȡsp3�ӻ���
�ʴ�Ϊ��sp3��
��ʯī��״�ṹ�У�ÿ��̼ԭ�ӱ������������ι��ã�����ƽ��ÿ����������ռ�е�̼ԭ����=6��![]() 3��
3��
�ʴ�Ϊ��3��

 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�