题目内容
【题目】许多元素及它们的化合物在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。
(2)某同学画出基态碳原子的核外电子排布图:![]() ,该电子排布图违背了__;CH3+、—CH3、CH3—都是重要的有机反应中间体。CH3+、CH3—的空间构型分别为___、____。
,该电子排布图违背了__;CH3+、—CH3、CH3—都是重要的有机反应中间体。CH3+、CH3—的空间构型分别为___、____。
(3)基态溴原子的价层电子轨道排布图为_______,第四周期中,与溴原子未成对电子数相同的金属元素有_______种。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
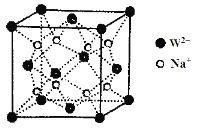
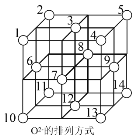
① 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为_____,已知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。
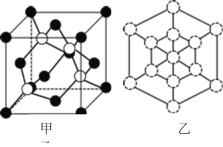
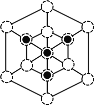
② 磷化硼晶胞沿着体对角线方向的投影(图乙中![]() 表示P原子的投影),用
表示P原子的投影),用![]() 画出B原子的投影位置_____。
画出B原子的投影位置_____。
(5)Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7号氧围成)和正八面体空隙(3、6、7、8、9、12号氧围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,晶体中正四面体空隙数与正八面休空隙数之比为__________,有__________%的正八面体空隙没有填充阳离子。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图),己知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为_____g(用a、NA表示)

【答案】原子光谱 洪特规则 平面三角形 三角锥形 ![]() 4种 面心立方最密堆积
4种 面心立方最密堆积 ![]()
 或
或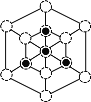 2:1 50(
2:1 50( ![]() (或
(或![]() )
)
【解析】
(1)光谱分析为利用原子光谱上的特征谱线来鉴定元素;(2) 当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同;CH3-中心碳原子是sp3杂化,而CH3+中的碳原子形成3个σ键,没有孤对电子,杂化轨道数目为3,中心碳原子是sp2杂化;(3)溴原子核外电子数为35,根据核外电子排布规律书写基态溴原子的电子排布式为1s22s22p63s23p63d104s24p5;根据溴原子的电子排布式确定未成对电子数,再根据第四周期中的金属元素分析解答;(4)①实心球为磷原子,根据晶胞结构分析,P做面心立方最密堆积,根据晶体密度ρ=![]() 计算;②根据晶胞结构分析,立方磷化硼晶胞沿着体对角线方向可以观察到六边形,中心B与P重合,六边形中形成两个倒立关系的正三角形,分别由3个B或者3个P形成;(5)根据晶体结构分析;(6)根据图知,每个Ni原子被3个O原子包围、每个O原子被3个Ni原子包围,如图
计算;②根据晶胞结构分析,立方磷化硼晶胞沿着体对角线方向可以观察到六边形,中心B与P重合,六边形中形成两个倒立关系的正三角形,分别由3个B或者3个P形成;(5)根据晶体结构分析;(6)根据图知,每个Ni原子被3个O原子包围、每个O原子被3个Ni原子包围,如图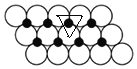 所示,相邻的3个圆中心连线为正三角形,三角形的边长为2apm,每个三角形含有一个Ni原子,三角形的面积=[
所示,相邻的3个圆中心连线为正三角形,三角形的边长为2apm,每个三角形含有一个Ni原子,三角形的面积=[![]() ×2a×2a×sin60°×10-24]m2=
×2a×2a×sin60°×10-24]m2=![]() ×10-24m2,如图
×10-24m2,如图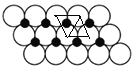 实际上每个Ni原子被两个小三角形包含小平行四边形面积为2
实际上每个Ni原子被两个小三角形包含小平行四边形面积为2![]() ×10-24m2,O原子个数=
×10-24m2,O原子个数=![]() ×6=1,每平方米面积上分散的该晶体的质量=
×6=1,每平方米面积上分散的该晶体的质量=![]() g。
g。
(1)光谱分析为利用原子光谱上的特征谱线来鉴定元素,所以在现代化学中,常利用原子光谱上的特征谱线来鉴定元素;(2)2p轨道上的2个电子没有分占不同轨道,且自旋方向相同,故该电子排布图违背了宏特规则;CH3+中心碳原子是sp2杂化,为平面三角形结构,而CH3-中心碳原子是sp3杂化,为三角锥形;(3)溴的原子的质子数为35,其价电子排布式为4s24p5,则基态溴原子的价层电子轨道排布图为![]() ,未成对电子数为1对,则第四周期中,与溴原子未成对电子数相同的金属元素有K、Sc、Cu和Ga共4种;(4)①实心球为磷原子,根据晶胞结构分析,P做面心立方最密堆积;1个晶胞中,含有P原子数目为8×
,未成对电子数为1对,则第四周期中,与溴原子未成对电子数相同的金属元素有K、Sc、Cu和Ga共4种;(4)①实心球为磷原子,根据晶胞结构分析,P做面心立方最密堆积;1个晶胞中,含有P原子数目为8×![]() +6×
+6×![]() =4个,含有B原子数目为4个,不妨取1mol这样的晶胞,即有NA个这样的晶胞,1mol晶胞的质量为m=42×4g,所以晶体密度为ρ=
=4个,含有B原子数目为4个,不妨取1mol这样的晶胞,即有NA个这样的晶胞,1mol晶胞的质量为m=42×4g,所以晶体密度为ρ=![]() =
=![]() g/cm3;②根据晶胞结构分析,立方磷化硼晶胞沿着体对角线方向可以观察到六边形,中心B与P重合,六边形中形成两个倒立关系的正三角形,分别由3个B或者3个P形成,所以画图为:
g/cm3;②根据晶胞结构分析,立方磷化硼晶胞沿着体对角线方向可以观察到六边形,中心B与P重合,六边形中形成两个倒立关系的正三角形,分别由3个B或者3个P形成,所以画图为: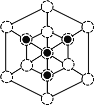 或
或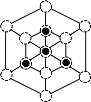 ;(5)结构中如1、3、6、7的O2-围成的正四面体空隙有8个,3、6、7、8、9、12的O2-围成的正八面体空隙有4个,则晶体中正四面体空隙数与正八面休空隙数之比为8:4=2:1;Fe3O4中有一半的Fe3+填充到正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则有50%的正八面体空隙没有填充阳离子;(6)根据图知,每个Ni原子被3个O原子包围、每个O原子被3个Ni原子包围,如图
;(5)结构中如1、3、6、7的O2-围成的正四面体空隙有8个,3、6、7、8、9、12的O2-围成的正八面体空隙有4个,则晶体中正四面体空隙数与正八面休空隙数之比为8:4=2:1;Fe3O4中有一半的Fe3+填充到正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则有50%的正八面体空隙没有填充阳离子;(6)根据图知,每个Ni原子被3个O原子包围、每个O原子被3个Ni原子包围,如图 所示,相邻的3个圆中心连线为正三角形,三角形的边长为2apm,每个三角形含有一个Ni原子,三角形的面积=[
所示,相邻的3个圆中心连线为正三角形,三角形的边长为2apm,每个三角形含有一个Ni原子,三角形的面积=[![]() ×2a×2a×sin60°×10-24]m2=
×2a×2a×sin60°×10-24]m2=![]() ×10-24m2,如图
×10-24m2,如图 实际上每个Ni原子被两个小三角形包含小平行四边形面积为2
实际上每个Ni原子被两个小三角形包含小平行四边形面积为2![]() ×10-24m2,O原子个数=
×10-24m2,O原子个数=![]() ×6=1,每平方米面积上分散的该晶体的质量=
×6=1,每平方米面积上分散的该晶体的质量=![]() g=
g=![]() g=
g=![]() g。
g。