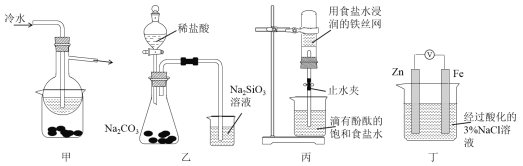
题目内容
【题目】X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Q+核外电子排布式为__________________。
(2)ZX3分子的空间构型为__________________, ZW3-离子的立体构型是__________。
(3)Y、R的最高价氧化物的沸点较高的是_______(填化学式),原因是_____________。
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为:______________________________________________。
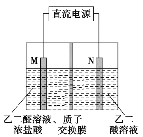
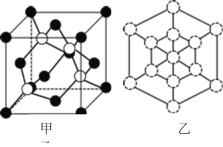
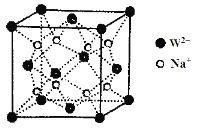
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为________(填化学式)。Na+的配位数为________,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。
【答案】1s22s22p63s23p63d10 三角锥形 平面三角形 SiO2 SiO2为原子晶体,CO2为分子晶体 2Cu + 8NH3 + O2 + 2H2O == 2[Cu(NH3)4]2+ + 4OH Na2O 4 立方体
【解析】
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,则X为H元素;Y有三个能级,且每个能级上的电子数相等,核外电子排布为1s22s22p2,故Y为C元素;R与Y同一主族,结合原子序数可以知道,R为Si元素;W与Z同周期,第一电离能比Z的低,故W为O元素;而Z原子单电子数在同周期元素中最多,则外围电子排布为ns2np3,原子序数小于O元素,故Z为N元素;Q的最外层只有一个电子,其他电子层电子均处于饱和状态,不可能为短周期元素,原子序数小于30,故核外电子排布为1s22s22p63s23p63d104s1,则Q为Cu元素.
(1)Cu+核外电子排布式为:1s22s22p63s23p63d10;
(2)ZX3为NH3,空间构型为三角锥形;ZW3-离子为NO3-,NO3-离子中N原子孤电子对数为(5+1-2×3)/2=0,价层电子对数为3+0=3,故其立体构型是平面三角形;
(3)Y、R的最高价氧化物分别为二氧化碳、二氧化硅,二氧化硅为原子晶体,二氧化碳为分子晶体,故沸点较高的是SiO2;
(4)将Cu单质的粉末加入到NH3的浓溶液中,并通入O2,充分反应后溶液呈深蓝色,反应生成[Cu(NH3)4]2+,该反应的离子方程式为: 2Cu + 8NH3 + O2 + 2H2O == 2[Cu(NH3)4]2+ + 4OH;
(5)晶胞中Na+离子数目为8,O2-离子数目为8×1/8+6×1/2=4,Na+离子、O2-离子数目之比为2:1,故该晶体化学式为Na2O,由图可以知道,每个Na+离子周围有4个O2-离子,Na+离子配位数为4,距一个阴离子周围最近的所有阳离子有8个,8个钠离子构成的几何体为立方体。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表。J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
J | ||||
R |
(1)M的离子结构示意图为__________;元素T在周期表中位于第________族。
(2)J和氢组成的化合物分子有6个原子,其分子式为______________。
(3)M和T形成的化合物在潮湿的空气中冒白烟,反应的化学方程式为___________。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为__________________________________________________________。
②L的另一种氢化物乙通常用作火箭的燃料,其组成原子数之比为1∶2,则乙的化学式为_____。