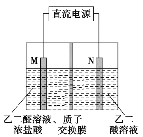
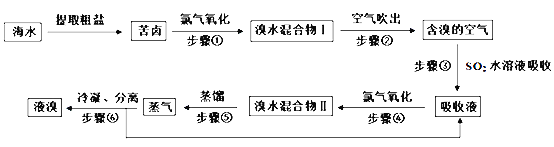
题目内容
【题目】常温下,向20mL 0.2mol/L H2X溶液中滴加0.2mol/L NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法不正确的是
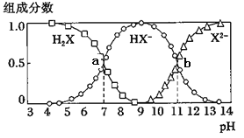
A. 水的电离程度: b点大于点a
B. 将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11
C. 常温下HY的K=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y—=HY+HX—
D. 常温下,反应X2— + H2O ![]() HX— + OH—的平衡常数对数值1gK= -3
HX— + OH—的平衡常数对数值1gK= -3
【答案】B
【解析】
A.a点溶液pH=7,H2X的电离与HX-的水解程度相同,水的电离基本不受影响,而b点溶液pH=11,A2-和HX-的水解程度明显大于HX-的电离,明显促进水的电离程度,即b点水的电离程度大于a点,故A正确;B.将等物质的量的NaHX、Na2X溶于水中,HX-电离程度大于A2-的水解程度,所以溶液中c(A2-)>c(HX-),则溶液PH大于11,故B错误;C.H2X的一级电离平衡常数K1=![]() ,pH=7时c(HX-)=c(H2X),则K1=c(H+)=10-7,H2X的二级电离平衡常数K2=
,pH=7时c(HX-)=c(H2X),则K1=c(H+)=10-7,H2X的二级电离平衡常数K2=![]() ,pH=11时c(HX-)=c(X2-),则K2=c(H+)=10-11,HY的KB=1×10-10,则酸性:H2X>HF>HX-,结合强酸制弱酸的原理,将少量H2X溶液加入到足量NaY溶液中,发生的反应为H2X+Y—=HY+HX—;故C正确;D.H2X的二级电离平衡常数K2=
,pH=11时c(HX-)=c(X2-),则K2=c(H+)=10-11,HY的KB=1×10-10,则酸性:H2X>HF>HX-,结合强酸制弱酸的原理,将少量H2X溶液加入到足量NaY溶液中,发生的反应为H2X+Y—=HY+HX—;故C正确;D.H2X的二级电离平衡常数K2=![]() ,pH=11时c(HX-)=c(X2-),则K2=c(H+)=10-11;25℃时,反应X2-+H2OHX-+OH-的平衡常数=
,pH=11时c(HX-)=c(X2-),则K2=c(H+)=10-11;25℃时,反应X2-+H2OHX-+OH-的平衡常数=![]() =
=![]() =10-3,平衡常数对数值1gK=-3,故D正确;故答案为B。
=10-3,平衡常数对数值1gK=-3,故D正确;故答案为B。

【题目】某学习小组通过下列装置探究 MnO2与FeCl3·6H2O反应产物。

(查阅资料)FeCl3是一种共价化合物,熔点306℃,沸点315℃。
实验编号 | 操作 | 现象 |
实验 1 | 按上图所示,加热A中MnO2与FeCl3·6H2O混合物 | ①试管A中固体部分变液态,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中KI-淀粉溶液变蓝 |
实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中固体部分变液态,产生白雾和黄色气体,B中KSCN溶液变红 |
(实验探究)实验操作和现象如下表:
(问题讨论)
(1)实验前首先要进行的操作是______________________________。
(2)实验1和实验2产生的白雾是_______(填化学式)溶解在水中形成的小液滴。
(3)请用离子方程式解释实验2中黄色气体使KI-淀粉溶液变蓝色的原因_____________。
(4)为确认黄色气体中含有Cl2,学习小组将实验1中试管B内KI-淀粉溶液替换为NaBr溶液,发现B中溶液呈橙色,经检验无Fe2+,说明黄色气体中含有Cl2。用铁氰化钾溶液检验Fe2+的离子方程式是_________________________________。选择NaBr溶液的原因是________________________________________________________________。
(实验结论)
(5)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________________________________。
(实验反思)
该学习小组认为实验1中溶液变蓝,也可能是酸性条件下,I-被空气氧化所致,可以先将装置中的空气排尽,以排除O2的干扰。