题目内容
9.硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7•10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质.以硼镁泥为原料制取的七水硫酸镁在印染、造纸和医药等工业上都有广泛的应用.硼镁泥制取七水硫酸镁的工艺流程如图:
回答下列问题:
(1)Na2B4O7•10H2O中B的化合价为+3.
(2)Na2B4O7易溶于水,也较易发生水解:B4O72-+7H2O?4H3BO3(硼酸)+2OH-,(硼酸在常温下溶解度较小).写出加入硫酸时Na2B4O7发生反应的化学方程式:Na2B4O7+H2SO4+5H2O═Na2SO4+4H3BO3↓.
(3)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,写出生成黑色固体的离子方程式ClO-+Mn2++H2O═MnO2+Cl-+2H+.
(4)加入MgO的目的是调节溶液的pH值,使Fe3+转化为Fe(OH)3除去.
(5)己知MgSO4、CaSO4的溶解度如表:
| 温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)Na2B4O7•10H2O失去全部结晶水后的硼砂与金属钠、氢气及石英砂一起反应可制备有机化学中的“万能还原剂--NaBH4”(该过程B的化合价不变).
①写出NaBH4的电子式
 .
.②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力.NaBH4的有效氢含量为0.21(计算结果保留两位小数).
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式BO2-+6H2O+8e-═BH4-+8OH-.
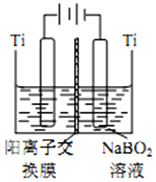
分析 分析流程,硼镁泥中主要有MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质,通过硫酸酸浸,得到滤渣为SiO2,滤液中含有Na+,Ca2+,Fe2+,Fe3+,Mn2+,H+,SO42-,B4O72-,经过NaClO溶液处理,NaClO在酸性溶液中具有一定的氧化性,将Fe2+氧化为Fe3+,将Mn2+氧化为MnO2,加入MgO处理,形成Fe(OH)3和MnO2,这就是滤渣B,滤液经过蒸发浓缩,趁热过滤,得到滤渣C为CaSO4•2H2O,此时滤液中存在Na+,B4O72-,SO42-,Mg2+,滤液经过冷却结晶,得到MgSO4•7H2O和硼砂溶液,据此分析;
(1)根据物质呈电中性原理,计算B的化合价;
(2)硼砂水解产生H3BO3,H3BO3是弱酸,在硼砂溶液中加入硫酸,可以制得H3BO3,据此写出反应的化学方程式;
(3)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,根据流程分析,应为MnO2,由NaClO在酸性溶液中氧化Mn2+得到,据此写出反应的离子方程式;
(4)加入MgO,使溶液中Fe3+产生Fe(OH)3沉淀,除去Fe3+,据此分析加入MgO的作用;
(5)操作“A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据溶解性数据的分析操作A的步骤;
(6)①NaBH4的电子式,存在Na+和BH4-,据此写出电子式;
②根据有效含氢量的定义,每克含氢还原剂的还原能力相当于多少克H2的还原能力,H2做还原剂,1molH2失去电子2mol,结合电子得失守恒计算;
③碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,阴极处发生的反应为物质得到电子,发生还原反应,考虑到溶液为碱性,OH-参加反应或反应生成OH-,据此写出电极反应式.
解答 解:(1)根据物质呈电中性原理,Na2B4O7•10H2O中Na为+1价,O为-2价,则B的化合价为$\frac{2×7-1×2}{4}$=+3,
故答案为:+3;
(2)硼砂水解产生H3BO3,H3BO3是弱酸,在硼砂溶液中加入硫酸,可以制得H3BO3,则加入硫酸时Na2B4O7发生反应的化学方程式为:Na2B4O7+H2SO4+5H2O═Na2SO4+4H3BO3,
故答案为:Na2B4O7+H2SO4+5H2O═Na2SO4+4H3BO3↓;
(3)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,根据流程分析,应为MnO2,由NaClO在酸性溶液中氧化Mn2+得到,考虑到介质为酸性,H+参与反应或反应生成H+,则生成黑色固体的离子方程式为:ClO-+Mn2++H2O═MnO2+Cl-+2H+,
故答案为:ClO-+Mn2++H2O═MnO2+Cl-+2H+;
(4)加入MgO,使溶液中Fe3+产生Fe(OH)3沉淀,除去Fe3+,则加入MgO的目的是:调节溶液的pH值,使Fe3+转化为Fe(OH)3除去,
故答案为:调节溶液的pH值,使Fe3+转化为Fe(OH)3除去;
(5)操作“A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据溶解性的数据分析,随着温度的升高,MgSO4的溶解度增加,CaSO4的溶解度降低,可见随着温度升高,二者溶解度差别增大,因此可考虑操作A中对溶液蒸发浓缩,可以析出大量的CaSO4固体,在温度高时,进行趁热过滤可以达到分离的目的,
故答案为:蒸发浓缩,趁热过滤;
(6)①NaBH4的电子式,存在Na+和BH4-,则NaBH4的电子式为: ,
,
故答案为: ;
;
②根据有效含氢量的定义,每克含氢还原剂的还原能力相当于多少克H2的还原能力,H2做还原剂,1molH2失去电子2mol,1gH2的物质的量为$\frac{1g}{2g/mol}$=0.5mol,0.5molH2转移的电子数为1mol,根据电子得失守恒,NaBH4也应转移1mol电子,NaBH4中H为-1价,做还原剂时,H从-1价升高为+1价,1molNaBH4转移电子数为4×2=8mol,则转移1mol电子消耗NaBH4的物质的量为0.125mol,其质量为0.125mol×38g/mol=4.75g,即1gH2相当于4.75gNaBH4,那么1gNaBH4相当于$\frac{1}{4.75}$gH2,即0.21gH2,
故答案为:0.21;
③碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,阴极处发生的反应为物质得到电子,发生还原反应,考虑到溶液为碱性,OH-参加反应或反应生成OH-,则阴极室的电极反应式为:BO2-+6H2O+8e-═BH4-+8OH-,
故答案为:BO2-+6H2O+8e-═BH4-+8OH-.
点评 本题考查无机工艺流程,以B元素为背景,硼砂是B的化合物中比较重要的物质,题目涉及到氧化还原反应方程式的书写,实验流程的分析,电子式的书写,电极反应式的书写,考查的知识点较综合,着重原理知识,题目难度中等.
值得一提的是,学过大学无机化学的元素化学这部分的,会知道硼族元素的B性质很有研究,硼砂水溶液是碱性的缓冲溶液,硼砂还可用于分析化学测定金属离子,叫做硼砂珠实验,B是典型的缺电子结构,对于硼氢化合物也叫硼烷,其结构又是一个研究,相比于有机化学的烷烃,无论是硼烷还是硅烷,数量还是有限的,硼烷的特殊结构就是由于B的缺电子结构导致,对于其结构也不是常有的理论解释,更多采用离域电子解释,由此也有威德规则解释单多面体硼烷几何构型和电子结构(高等无机化学中会详细解释),也由于B的缺电子结构,硼卤烷常作为路易斯酸,在有机化学领域又有着应用,总之,无机元素化学是无机化学中一块很有研究价值的领域,无机化学的丰富性在于此.

| 容器 | 温度/K | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | SO2或SO3平衡转化率 | ||
| c(SO2) | c(O2) | c(SO3) | c(SO3) | |||
| Ⅰ | 723 | 0.2 | 0.1 | 0 | 0.16 | α1 |
| Ⅱ | 723 | 0.4 | 0.2 | 0 | α2 | |
| Ⅲ | 823 | 0 | 0 | 0.2 | α3 | |
| A. | 达到平衡时,α1+α3>1 | |
| B. | 达到平衡时,容器中的压强:PⅡ>PⅠ>PⅢ | |
| C. | 达到平衡时,容器Ⅲ中的逆反应速率比容器Ⅰ中的大 | |
| D. | 若起始时,向容器Ⅰ中充入0.16 mol SO2、0.04 mol O2和0.16 mol SO3,则此时反应向逆反应方向进行 |
| A. | CH3OH | B. | CH2OHCH2CH3 | C. | (CH3)2COHCH3 | D. | (CH3)3COH |
| 选项 | 物质 | 除杂试剂 | 分离方法 |
| A | 乙醇 (乙酸) | CaO | 蒸馏 |
| B | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| C | 苯(苯酚) | 浓溴水 | 过滤 |
| D | CH3CH2Br(Br2) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 乙烯在一定条件下与水反应 | |
| B. | 在光照条件下,甲烷与氯气的反应 | |
| C. | 在一定条件下,苯与氯气的反应 | |
| D. | 乙烯通入溴的四氯化碳溶液中的反应 |
| A. | 8mL | B. | 8.5mL | C. | l0mL | D. | 10.5mL |
| A. | 乙烯和聚乙烯均能使溴水褪色 | |
| B. | 乙酸和乙酸乙酯均能发生取代反应 | |
| C. | 甲烷、苯和油脂均不能使酸性KMnO4溶液褪色 | |
| D. | 葡萄糖与果糖、淀粉与纤维素分子式相同,均互为同分异构体 |
| A. | pH=7的溶液 | |
| B. | 加酚酞试液后呈无色的溶液 | |
| C. | c(H+)=c(OH-)=10-6mol/L的溶液 | |
| D. | 由等物质的量的强酸与强碱反应得到的溶液 |

 .
.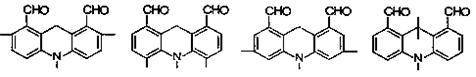 .
. 结构;
结构;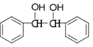 写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)
写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)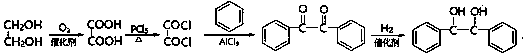 .
.