题目内容
1.常温下将盛有10mL NO2和10mL NO的混合气体的试管倒立于水槽中并向其中通入O2,一段时间后,试管内还剩余2mL气体,则通入O2的体积可能为( )| A. | 8mL | B. | 8.5mL | C. | l0mL | D. | 10.5mL |
分析 剩余的气体可能为氧气,有可能为NO,①当剩余的气体为氧气时,二氧化氮和NO完全反应,可以根据方程式4NO2+O2+2H2O═4HNO3、4NO+3O2+2H2O═4HNO3计算出通入氧气的总体积;
②当剩余的气体为NO时,可以看作二氧化氮完全反应,NO反应消耗了8mL,还剩余2mL,然后根据反应方程式计算出消耗的氧气的体积.
解答 解:①当剩下的气体为O2时,10mLNO2和10mL NO说明完全反应生成硝酸,则:
4NO2+O2+2H2O═4HNO3,4NO+3O2+2H2O═4HNO3,
4 1 4 3
10mL 2.5mL 10mL 7.5mL
所以通入的氧气体积为:2.5mL+7.5mL+2mL=12mL;
②当剩余的气体为NO时,可以认为10mL NO2完全反应生成硝酸,10mLNO中剩余2mL,有8mL转化成硝酸,则:
4NO2+O2+2H2O═4HNO3,4NO+3O2+2H2O═4HNO3,
4 1 4 3
10mL 2.5mL 8mL 6mL
所以通入氧气的体积为:2.5mL+6mL=8.5mL,
故选B.
点评 本题考查了有关混合物反应的化学计算,题目难度中等,明确反应后剩余气体组成为解答关键,注意掌握NO、二氧化氮与氧气、水转化成硝酸的反应原理,要求学生掌握讨论法在化学计算中的应用.

练习册系列答案
相关题目
2.下列物质转化在给定条件下能实现的是( )
| A. | Fe2O3$\stackrel{HCI(ap)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| B. | 饱和NaCl(aq) $\stackrel{NH_{3},CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Al2O3$\stackrel{NaOH(ap)}{→}$NaAlO2(aq) $\stackrel{过量HCI}{→}$Al(OH)3 | |
| D. | 海水$\stackrel{Ca(OH)_{2}}{→}$Mg(OH)2$\stackrel{HCI(ap)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
3.用一定方法可除去下列物质所含的少量杂质(括号内为杂质),其中所加物质能达到除杂目的是( )
| A. | Cl2(HCl)用NaOH溶液 | B. | Na2CO3(NaHCO3)用HCl溶液 | ||
| C. | NaCl溶液(I2)用CCl4 | D. | FeCl2(FeCl3)通入Cl2 |
9.硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7•10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质.以硼镁泥为原料制取的七水硫酸镁在印染、造纸和医药等工业上都有广泛的应用.硼镁泥制取七水硫酸镁的工艺流程如图:

回答下列问题:
(1)Na2B4O7•10H2O中B的化合价为+3.
(2)Na2B4O7易溶于水,也较易发生水解:B4O72-+7H2O?4H3BO3(硼酸)+2OH-,(硼酸在常温下溶解度较小).写出加入硫酸时Na2B4O7发生反应的化学方程式:Na2B4O7+H2SO4+5H2O═Na2SO4+4H3BO3↓.
(3)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,写出生成黑色固体的离子方程式ClO-+Mn2++H2O═MnO2+Cl-+2H+.
(4)加入MgO的目的是调节溶液的pH值,使Fe3+转化为Fe(OH)3除去.
(5)己知MgSO4、CaSO4的溶解度如表:
操作“A”是将MgSO4和CaSO4混合溶液中的CaS、SO4除去,根据上表数据,简要说明“操作A”步骤为蒸发浓缩,趁热过滤.
(6)Na2B4O7•10H2O失去全部结晶水后的硼砂与金属钠、氢气及石英砂一起反应可制备有机化学中的“万能还原剂--NaBH4”(该过程B的化合价不变).
①写出NaBH4的电子式 .
.
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力.NaBH4的有效氢含量为0.21(计算结果保留两位小数).
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式BO2-+6H2O+8e-═BH4-+8OH-.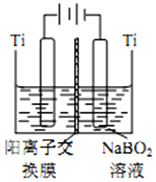

回答下列问题:
(1)Na2B4O7•10H2O中B的化合价为+3.
(2)Na2B4O7易溶于水,也较易发生水解:B4O72-+7H2O?4H3BO3(硼酸)+2OH-,(硼酸在常温下溶解度较小).写出加入硫酸时Na2B4O7发生反应的化学方程式:Na2B4O7+H2SO4+5H2O═Na2SO4+4H3BO3↓.
(3)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,写出生成黑色固体的离子方程式ClO-+Mn2++H2O═MnO2+Cl-+2H+.
(4)加入MgO的目的是调节溶液的pH值,使Fe3+转化为Fe(OH)3除去.
(5)己知MgSO4、CaSO4的溶解度如表:
| 温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)Na2B4O7•10H2O失去全部结晶水后的硼砂与金属钠、氢气及石英砂一起反应可制备有机化学中的“万能还原剂--NaBH4”(该过程B的化合价不变).
①写出NaBH4的电子式
 .
.②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力.NaBH4的有效氢含量为0.21(计算结果保留两位小数).
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式BO2-+6H2O+8e-═BH4-+8OH-.

16.对于1mol/L的NaOH溶液,下列有关说法正确的是(NA表示阿伏加德罗常数)( )
| A. | Na+的数目为NA | B. | OH-的物质的量为1mol | ||
| C. | Na+的物质的量浓度为1mol/L | D. | NaOH的质量为40g |
6.反应N2(g)+3H2(g)?2NH3(g)是一放热反应.如果反应在密闭容器中进行,下列有关说法中正确的是( )
| A. | 升高温度会使正反应速率升高逆反应速率减慢 | |
| B. | 在高温和催化剂作用下,H2可以100%地转化为NH3 | |
| C. | 当NH3的浓度是N2的二倍时,反应达到平衡状态 | |
| D. | 使用催化剂可以加快反应速率,提高生产效率 |
13.短周期主族元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )
| Z | |
| X | Y |
| A. | Z元素的最高正化合价,一定等于其主族序数 | |
| B. | 它们的原子半径由大到小的顺序一定是Y>X>Z | |
| C. | 若它们的原子最外层电子数之和为11,则它们均为非金属元素 | |
| D. | 若它们均为非金属元素,则X与氧元素组成的物质一定是酸性氧化物 |
10.用10.6g的Na2CO3固体配成溶液500mL,所得溶液的物质的量浓度为( )
| A. | 0.2mol/L | B. | 0.5mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 32g O2和O3的混合物中含有的分子数目为2NA | |
| B. | 标准状况下,22.4L二氯甲烷含有NA个分子 | |
| C. | 25℃,1L pH=1的硫酸溶液中,H+的数目为0.2NA | |
| D. | 10g 46%的乙醇溶液中含有的氧原子数目为0.4NA |