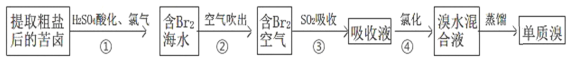
题目内容
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为______________。
(2)A与溴的四氯化碳溶液反应的化学方程式为_________________________________,反应类型是________。
(3)已知:![]()
![]()
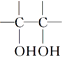 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应产物的结构简式:_____________________。
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应产物的结构简式:_____________________。
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式_________________________。
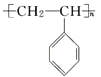
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为_______________。
【答案】C8H8![]()
![]() 加成反应
加成反应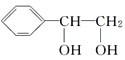
![]()
【解析】
(1)根据相对分子质量和含碳量可计算含氢量,进而计算C、H原子数目,可知分子式;
(2)该物质含有苯环,能与溴发生反应,说明A应为苯乙烯;
(3)A中含有碳碳双键,结合信息可知生成物;
(4)一定条件下,A与氢气反应,可得乙苯或乙基环己烷,结合含氢量判断;
(5)含有碳碳双键,可发生加聚反应生成聚苯乙烯。
(1)1molA中n(C)=104g×92.3%/12g·mol-1=8mol,n(H)=104g×(192.3%)/1g·mol-1=8mol,则分子式为C8H8;
(2)该物质含有苯环,能与溴发生反应,说明A应为苯乙烯,结构简式为![]() ,与溴发生加成反应生成
,与溴发生加成反应生成![]() ,则反应的方程式为
,则反应的方程式为![]() +Br2
+Br2![]()
![]() ;
;
(3)根据已知信息可知形成邻二醇结构,该醇比烯烃多两个氢原子,可知![]() 被氧化生成
被氧化生成![]() ;
;
(4)一定条件下,A与氢气反应,可得乙苯或乙基环己烷,得到的化合物中碳的质量分数为85.7%,应为![]() ,其中ω(C)=12×8/112×100%=85.7%;
,其中ω(C)=12×8/112×100%=85.7%;
(5)含有碳碳双键,可发生加聚反应生成聚苯乙烯,结构简式为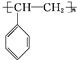 。
。

【题目】(1)在试管Ⅰ和Ⅱ中分别加入3mL稀盐酸(均足量),再将装有0.3gNaHCO3和0.3gNa2CO3粉末的小气球分别套在Ⅰ和Ⅱ的管口。各将气球内的NaHCO3、Na2CO3同时倒入试管中,回答:
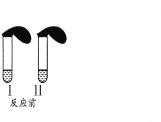
①I试管发生的离子方程式: _______________________;
②两支试管中充分反应后生成的气体总量Ⅰ_____Ⅱ,反应结束时消耗盐酸的物质的量Ⅰ_____Ⅱ(填“>”“=”或“<”)。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和盐酸反应为吸热反应,而Na2CO3和盐酸反应为放热反应。乙同学认为甲同学的判断太武断,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
1 | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
2 | 50mL水 | 3.2gNa2CO3固体 | 20℃ | 24.3℃ |
3 | 35mL稀盐酸 | 含2.5gNaHCO3的饱和溶液15mL | 20℃ | 18.8℃ |
4 | 35mL稀盐酸 | 含3.2gNa2CO3饱和溶液15mL[来 | 20℃ | 24.2℃ |
5 | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | T℃ |
6 | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出:
①Na2CO3的饱和溶液和盐酸的反应是___________(吸热或放热)反应;
②NaHCO3的饱和溶液和盐酸的反应是__________(吸热或放热)反应;
③表中⑤号试验混合后温度T℃可能是(填编号)_________________________。
A.18.5℃ B. 24.2℃ C.16.2℃