题目内容
【题目】(题文)海洋是一座巨大的化学资源宝库,从中可以提取许多常见的化学物质,结合所学知识回答下列问题,
(1)“吹出法”提溴空气吹出法是工业规模提溴的常用方法,其流程如下:

其中步骤②~④的目的是________________________________________________。步骤③反应的离子方程式为_______________________________。除SO2外,步骤③还可以选用Na2CO3溶液吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1molBr2时,转移电子的物质的量为____________mol。
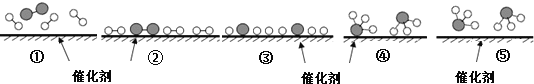
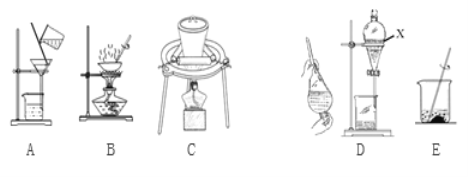
(2)实验室模拟从海带中提取碘,可能经历如下操作(或过程),请选择必要的操作(或过程),并按实验的先后顺序排列___________________________(填写编号)
(3)卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。现以卤块为原料按下图流程制备轻质氧化镁,若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,回答下列问题:


已知:Fe2+氢氧化物呈絮状,不易从溶液中除去。
步骤①反应的离子方程式为:_____________________________________;
步骤②的反应方程式为:_________________________________________。
【答案】富集溴元素(或提高溴水浓度)SO2+Br2+2H2O=4H++SO42-+2Br-5/3CEADClO-+2H++2Fe2+=2Fe3++Cl-+H2OMgCO3+H2O![]() Mg(OH)2+CO2↑
Mg(OH)2+CO2↑
【解析】
(1)氧化后的海水虽然含有溴单质,但浓度低,如県直接蒸馏原料,生产成本高。“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的浓缩过程;Na2CO3溶液吸收溴反应配平可得:3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6 NaHCO3,其中溴与转移的电子的关系为:3Br2-5e-,故答案为:富集元素(或提高溴水浓度)、SO2+Br2+2H2O=4H++SO42-+2Br-;吸收1molBr2时,转移电子的物质的量为![]() mol;
mol;
(2)由从海带中提取碘的实验分析可得结论,故答案为CEAD;
(3)步骤①是为了将Fe2+氧化成Fe3+,并在控制合通适的pH条件时生成Fe(OH)3沉淀而除之,虽然漂液和H2O2都可采用,但对比表2提供的原料价格可以看出,漂液比H2O2的价格低得多,所以选漂液最合理,故X为漂液;加入Y的目的是使镁离子沉淀,Y为纯碱,故答案为:ClO-+2H++2Fe2+=2Fe3++Cl-+H2O、MgCO3+H2O![]() Mg(OH)2+CO2↑。
Mg(OH)2+CO2↑。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案