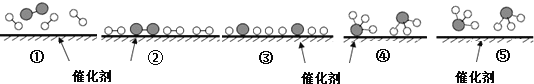
题目内容
【题目】现有A、B、C、D四种短周期元素,B是非金属性最强的元素,A分别与 B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三种分子中含相同数目的质子,乙常温下为液态化合物, C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示:

(1)写出B+乙 → 甲+C的化学反应方程式___________________________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是_______。(填写序号)
①A ②B ③C ④D
(3)依据下列条件可以进一步确定上述第四种元素:① 甲与丙以及乙与丙均能够发生反应,
② 甲、丙都是无色、有刺激性气味的物质。据此,请回答下列问题:写出上述第四种元素在周期表中第_________ 周期第_________ 族;写出 C+丙 → 乙+丁 的化学反应方程式_________________。
【答案】2F2+2H2O===4HF+O2 ④ 二 ⅤA 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
【解析】
A、B、C、D四种短周期元素,B是非金属性最强的元素,B为氟元素;A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙3分子中含相同数目的质子数,乙常温下为液态化合物,乙为水;乙和B单质反应生成C单质和化合物甲,反应是置换反应,则C为氧元素,化合物甲为HF,则A为H元素;化合物丙所含质子数与水和HF相同,则丙是NH3或CH4;C、D结合生成化合物丁,根据框图,氧气和丙能够反应生成丁和水,丁是NO或CO2,D是N或C元素,据此分析解答。
根据上述分析,A是H元素,B是F元素,C是O元素,D是N或C元素,甲是HF,乙是H2O,丙是NH3或CH4,丁是NO或CO2。
(1)B+乙→甲+C的反应是氟气和水反应生成氟化氢和氧气,化学反应方程式:2F2+2H2O=4HF+O2,故答案为:2F2+2H2O=4HF+O2;
(2)依据分析可知,D元素不能确定,故答案为:④;
(3)①甲是HF,乙是H2O,丙是NH3或CH4,根据甲与丙以及乙与丙均能够发生反应,可以判断丙是NH3;②甲、丙、丁都是无色有刺激性气味的物质,因此丁为NO ,则D为氮元素,在元素周期表中位于第二周期第VA族,C+丙→乙+丁的化学反应方程式:4NH3+5O2 ![]() 4NO+6H2O,故答案为:二;VA;4NH3+5O2
4NO+6H2O,故答案为:二;VA;4NH3+5O2 ![]() 4NO+6H2O。
4NO+6H2O。

 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料Mg0:MgSO4(s)+CO(g) ![]() MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 压强 | CO2与CO的物质的量之比 |
B | 温度 | 容器内混合气体的密度 |
C | MgSO4的质量(忽略体积) | CO的转化率 |
D | SO2的浓度 | 平衡常数K |
A. A B. B C. C D. D