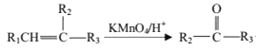题目内容
【题目】硝酸钙晶体[Ca(NO3)2·4H2O]常用于电子、仪表及冶金工业。一种利用CaO制备Ca(NO3)2·4H2O的流程如下:
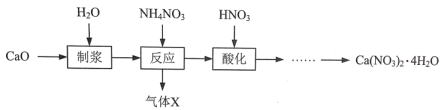
(1)“制浆”过程中发生反应的化学方程式是_________。
(2)“气体X”的化学式是_________ ,生成气体X发生反应的化学方程式是_________。
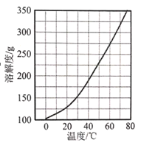
(3)Ca(NO3)2·4H2O的溶解度随温度变化的曲线如图所示,“酸化”后制取Ca(NO3)2·4H2O的操作主要包括加热浓缩、___、 过滤、洗涤、干燥。实验室过滤操作必须用到的玻璃仪器有烧杯、玻璃棒和 ____ 。
【答案】CaO+ H2O=Ca(OH)2 NH3 2NH4NO3 + Ca(OH)2 = Ca (NO3)2+2NH3↑+2H2O 冷却结晶或降温结晶 漏斗
【解析】
“制浆”过程中制浆的时候加入的是氧化钙和水,CaO+ H2O=Ca(OH)2,氢氧化钙与硝酸铵反应生成氨气,2NH4NO3+ Ca(OH)2= Ca (NO3)2+2NH3↑+2H2O,从溶液中获得晶体需要蒸发浓缩,降温结晶,过滤,洗涤,干燥,过滤操作必须用到的玻璃仪器有烧杯、玻璃棒和漏斗。
(1)“制浆”过程中制浆的时候加入的是氧化钙和水,发生反应的化学方程式是CaO+ H2O==Ca(OH)2。故答案为:CaO+ H2O==Ca(OH)2;
(2)制浆时生成了Ca(OH)2,氢氧化钙与硝酸铵反应生成氨气,故放出的气体是氨气,“气体X”的化学式是NH3,生成气体X发生反应的化学方程式是2NH4NO3+ Ca(OH)2= Ca (NO3)2+2NH3↑+2H2O。故答案为:NH3;2NH4NO3+ Ca(OH)2= Ca (NO3)2+2NH3↑+2H2O;
(3)从溶液中获得晶体需要蒸发浓缩,降温结晶,过滤,洗涤,干燥,“酸化”后制取Ca(NO3)2·4H2O的操作主要包括加热浓缩、冷却结晶或降温结晶、 过滤、洗涤、干燥。实验室过滤操作必须用到的玻璃仪器有烧杯、玻璃棒和漏斗 。故答案为:冷却结晶或降温结晶;漏斗。

【题目】有机物 W 在医药和新材料等领域有广泛应用。W 的一种合成路线如图:
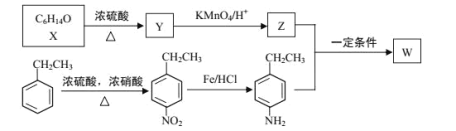
已知部分信息如下:
① | 1molY完全反应生成2molZ,且在加热条件下Z不能和新制氢氧化铜悬浊液反应 |
② |
|
③ | RCH2NH2+ |
请回答下列问题:
(1)Y 的化学名称是___;Z 中官能团的名称是___;
(2)![]() 中_____________(填“有”或“无”)手性碳原子;图示中 X 转化为 Y 的反应类型是___。
中_____________(填“有”或“无”)手性碳原子;图示中 X 转化为 Y 的反应类型是___。
(3)生成 W 的化学方程式为___。
(4)G 是对硝基乙苯的同分异构体,G 能和碳酸钠反应产生气体且分子中含有—NH2(氨基),G的同分异构体有___种(不考虑立体结构),其中在核磁共振氢谱上峰的面积比为 1∶2∶2∶2∶2 的结构简式为_________________。
(5)设计以苯乙烯和丙酮为原料制备药物中间体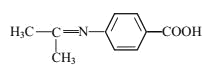 的合成路线__________(无机试剂自选)。
的合成路线__________(无机试剂自选)。