题目内容
10.将HCl、SO2、CO2、O2和N2的混合气体,依次通过氢氧化钠溶液,浓硫酸和灼热的铜丝(均充分反应),最后剩余气体为N2.分析 氢氧化钠与能够与氯化氢、二氧化硫、二氧化碳反应,剩余气体为氧气和氮气,通过浓硫酸干燥,与灼热的铜丝反应,氧气能够与铜反应生成氧化铜,最后剩余为氮气,据此解答.
解答 解:HCl、SO2、CO2、O2和N2的混合气体,依次通过氢氧化钠溶液,氯化氢与氢氧化钠反应生成氯化钠和水,二氧化硫、二氧化碳为酸性氧化物能够与氢氧化钠反应生成亚硫酸钠、碳酸钠和水,被氢氧化钠吸收,剩余氧气和氮气经过浓硫酸干燥,与铜丝反应,氧气能够与铜丝反应生成氧化铜,氮气不能够与铜反应,所以氧气被吸收,剩余气体为氮气,
故答案为:N2.
点评 本题考查了常见气体的性质,熟练掌握常见气体的性质是正确解答此类题的关键,题目难度不大.

练习册系列答案
相关题目
5.下列反应的离子方程式正确的是( )
| A. | NH4HCO3溶液中加入过量NaOH溶液:HCO3-+OH-═H2O+CO2 | |
| B. | 向次氯酸钠溶液中通入少量二氧化碳:2ClO-+H2O+CO2═2HClO+CO32- | |
| C. | 向乙二酸(H2C2O4)溶液中滴入少量氢氧化钠溶液:H2C2O4+2OH-═C2O42-+2H2O | |
| D. | 向氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
6.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表,下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/(mol•L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度/(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 该反应的化学方程式为3X(g)+Y(g)?2Z(g) | |
| C. | 25℃时,该反应的平衡常数为1600 | |
| D. | 改变温度可以改变此反应的平衡常数 |
3.下列说法正确的是( )
| A. | 摩尔是物质的数量单位 | |
| B. | 58.5 gNaCl溶解在1 L水中,得到溶液的物质的量浓度为1mol/L | |
| C. | 标况下,1 mol CCl4 所占的体积约为22.4 L | |
| D. | 12g12C含有的碳原子数约为6.02×1023个 |
 .
.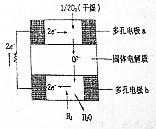 燃料电池作为一种新型能源由于电极材料丰富,电解质多样(可以是固态、液态、气态等),将渗透到我们生活的各个领域.
燃料电池作为一种新型能源由于电极材料丰富,电解质多样(可以是固态、液态、气态等),将渗透到我们生活的各个领域.