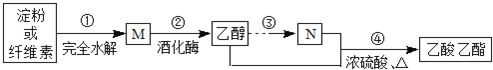
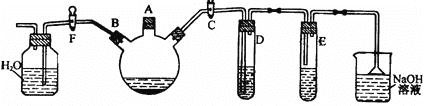
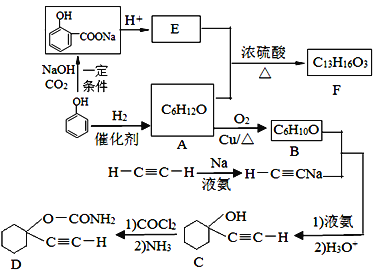
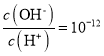题目内容
【题目】水垢中含有的 CaSO4,可先用 Na2CO3 溶液处理,使之转化为疏松、易溶于酸的 CaCO3。某化学兴趣小组用某浓度的 Na2CO3 溶液处理一定量的 CaSO4 固体,测得所加 Na2CO3 溶液体积与溶液中-lgc(CO32-)的关系如下:
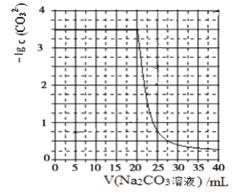
已知Ksp(CaSO4)=9×10-6,Ksp(CaCO3)=3×10-9,lg3=0.5,下列说法不正确的是
A.曲线上各点的溶液满足关系式![]()
B.CaSO4(s)+ ![]() (aq)
(aq)![]() CaCO3(s)+
CaCO3(s)+![]() (aq)K=3×103
(aq)K=3×103
C.该Na2CO3溶液的浓度为1.5 mol/L
D.相同实验条件下,若将Na2CO3溶液的浓度改为原浓度的2倍,则上图曲线整体向上平移1个单位即可
【答案】CD
【解析】
A.用某浓度的 Na2CO3 溶液处理一定量的 CaSO4 固体,CaSO4沉淀转化为CaCO3,CaSO4(s)+CO32-(aq)CaCO3(s)+SO42-(aq),根据平衡曲线,始终都有CaSO4固体,因此满足![]() ,故A正确;
,故A正确;
B.CaSO4(s)+CO32-(aq)CaCO3(s)+SO42-(aq),K=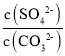 =
=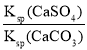 =
=![]() =3×103,故B正确;
=3×103,故B正确;
C.用某浓度的 Na2CO3 溶液处理一定量的 CaSO4 固体,CaSO4(s)+CO32-(aq)CaCO3(s)+SO42-(aq) K=3×103,溶液体积就是碳酸钠溶液的体积,每消耗1mol碳酸钠生成1mol硫酸根离子,在硫酸钙完全溶解前溶液中生成的硫酸根离子浓度等于碳酸钠溶液的浓度,若碳酸钠溶液浓度1.5mol/L,则硫酸根离子浓度为1.5mol/L,代入K=3×103,得到碳酸根离子浓度=0.5×10-3mol/L,-lgc(CO32-)=-lg(![]() ×10-3)=2.7,与图象不一致,故C错误;
×10-3)=2.7,与图象不一致,故C错误;
D.设碳酸钠溶液浓度xmol/L,则硫酸根离子浓度为xmol/L,代入K=3×103,得到碳酸根离子浓度=![]() ×10-3mol/L,根据图象,当碳酸钠溶液体积为20mL时,-lgc(CO32-)=-lg(
×10-3mol/L,根据图象,当碳酸钠溶液体积为20mL时,-lgc(CO32-)=-lg(![]() ×10-3)=3.5,解得:x=1;相同实验条件下,若将碳酸钠溶液的浓度改为原浓度的2倍,则消耗Na2CO3溶液体积为10mL,在CaSO4完全溶解前,c(SO42-)=2mol/L,K=
×10-3)=3.5,解得:x=1;相同实验条件下,若将碳酸钠溶液的浓度改为原浓度的2倍,则消耗Na2CO3溶液体积为10mL,在CaSO4完全溶解前,c(SO42-)=2mol/L,K=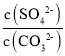 =3×103,推出溶液中c(CO32-)=
=3×103,推出溶液中c(CO32-)=![]() ×10-3mol/L,-lgc(CO32-)=-lg(
×10-3mol/L,-lgc(CO32-)=-lg(![]() ×10-3)=3.2,横坐标和纵坐标都要改变,故D错误;
×10-3)=3.2,横坐标和纵坐标都要改变,故D错误;
故选CD。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案【题目】FeSO4 溶液放置在空气中容易变质,因此为了方便使用 Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)26H2O],它比绿矾或绿矾溶液更稳定。(稳定是指物质放置 在空气中不易发生各种化学反应而变质)
I.硫酸亚铁铵晶体的制备与检验
(1)某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都必须煮沸、冷却后再使用,这样处理蒸馏水的目的是_______。向 FeSO4 溶液中加入饱和(NH4)2SO4 溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一 种浅蓝绿色的晶体。
(2)该小组同学继续设计实验证明所制得晶体的成分。
①如图所示实验的目的是_______,C 装置的作用是_______。
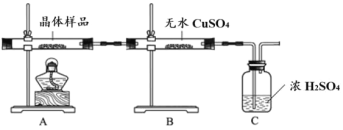
取少量晶体溶于水,得淡绿色待测液。
②取少量待测液,_______ (填操作与现象),证明所制得的晶体中有 Fe2+。
③取少量待测液,经其它实验证明晶体中有NH4+和SO42-
II.实验探究影响溶液中 Fe2+稳定性的因素
(3)配制 0.8 mol/L 的 FeSO4 溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2 溶液(pH=4.0),各取 2 ml 上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分钟后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液;FeSO4溶液则出现淡黄色浑浊。
(资料 1)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.6 | 2.7 |
完全沉淀pH | 9.6 | 3.7 |
①请用离子方程式解释 FeSO4 溶液产生淡黄色浑浊的原因_______。
②讨论影响 Fe2+稳定性的因素,小组同学提出以下 3 种假设:
假设 1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2 溶液中 Fe2+稳定性较好。
假设 2:其它条件相同时,在一定 pH 范围内,溶液 pH 越小 Fe2+稳定性越好。
假设 3:_______。
(4)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分 别控制溶液 A(0.2 mol/L NaCl)和溶液 B(0.1mol/L FeSO4)为不同的 pH,

观察记录电流计读数,对假设 2 进行实验研究,实验结果如表所示。
序号 | A:0.2mol·L-1NaCl | B:0.1mol·L-1FeSO4 | 电流计读数 |
实验1 | pH=1 | pH=5 | 8.4 |
实验2 | pH=1 | pH=1 | 6.5 |
实验3 | pH=6 | pH=5 | 7.8 |
实验4 | pH=6 | pH=1 | 5.5 |
(资料 2)原电池装置中,其它条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原 电池的电流越大。
(资料 3)常温下,0.1mol/L pH=1 的 FeSO4 溶液比 pH=5 的 FeSO4 溶液稳定性更好。 根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U 型管中左池的电极反应式____________。
②对比实验 1 和 2(或 3 和 4) ,在一定 pH 范围内,可得出的结论为____________。
③对比实验____________和____________,还可得出在一定pH 范围内溶液酸碱性变化对 O2 氧化性强弱的影响因素。
④ 对(资料 3)实验事实的解释为____________。