题目内容
已知1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则该反应的热化学方程式正确的是( )
A. N2H4+O2=N2+2H2O△H= —534.4kJ/mol
B. N2H4(g)+ O2(g)=N2(g)+2H2O(g)△H= —16.7kJ/mol
C. N2H4(g)+O2(g)=N2(g)+2H2O(l)△H= —534.4kJ/mol
D. N2H4(g)+O2(g)=N2(g)+2H2O(g)△H= —534.4kJ/mol
练习册系列答案
相关题目
五种短周期元素的某些性质如下所示,有关说法不正确的是
元素 | 元素的相关信息 |
M | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
N | 原子的M电子层上有3个电子 |
W | 在短周期元素中,其原子半径最大 |
X | 其最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成X的单质和H2O |
Y | 元素最高价正价与最低负价的代数和为6 |
A. M的气态氢化物具有还原性,常温下,该氢化物水溶液的pH>7
B. W单质在氧气中燃烧后的产物中阴阳离子个数之比为1:2
C. 由N和Y所形成的化合物中存在离子键,属于离子化合物
D. N、W、X的最高价氧化物对应的水化物两两之间能相互发生反应


 C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是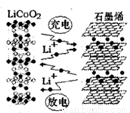
 产的产品属于
产的产品属于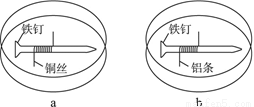
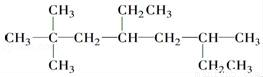 的名称为________________________.
的名称为________________________. 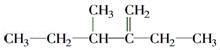 的名称为______________________________.
的名称为______________________________.  结构简式:__________________________________.
结构简式:__________________________________.