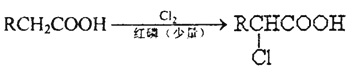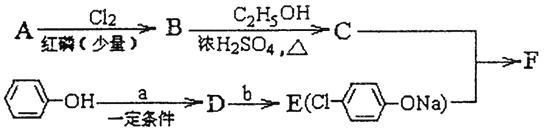题目内容
【题目】能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化.请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程.已知反应:N2(g)+3H2(g)2NH3(g)△H=﹣93kJmol﹣1 . 试根据表中所列键能数据,计算a 的数值为kJ/mol.
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | a | 945 |
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景.已知在常压下有如下变化: ①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=a kJ/mol
②H2O(g)═H2O(l)△H=b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式: .
(3)已知:HCN(aq)与NaOH(aq)反应的焓变△H=﹣12.1kJmol﹣1; HCl(aq)与NaOH(aq)反应的焓变△H=﹣55.6kJmol﹣1 . 则HCN在水溶液中电离的焓变△H等于 .
(4)已知:H2(g)+ ![]() O2(g)═H2O(1)△H=﹣285.83kJmol﹣1CO(g)+
O2(g)═H2O(1)△H=﹣285.83kJmol﹣1CO(g)+ ![]() O2(g)═CO2(g)△H=﹣282.9kJmol﹣1;
O2(g)═CO2(g)△H=﹣282.9kJmol﹣1;
若氢气与一氧化碳的混合气体完全燃烧可生成5.4g H2O(l),并放出114.3kJ的热量,则混合气中CO的物质的量为(计算结果保留一位小数)
【答案】
(1)391
(2)2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=(a+4b)kJ/mol
(3)+43.5kJ?mol﹣1
(4)0.1mol
【解析】解:(1)N2(g)+3H2(g)2NH3(g)△H=﹣93kJmol﹣1,化学反应的焓变=反应物键能总和﹣生成物键能总和,所以得到﹣93KJ/mol=945KJ/mol+3×436KJ/mol﹣6×a,解得a=391KJ/mol;
所以答案是:391;(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=a kJ/mol
②H2O(g)=H2O(l)△H=b kJ/mol
①+②×4得到液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=(a+4b) kJ/mol;
所以答案是:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=(a+4b) kJ/mol;(3)①HCN(aq)H+(aq)+CN﹣(aq)△H1,
②H+(aq)+OH﹣(aq)=H2O(l)△H2=﹣55.6kJmol﹣1,
③NaOH(aq)+HCN(aq)=NaCN(aq)+H2O(l),△H3=﹣12.1kJmol﹣1,
盖斯定律计算①+②=③,△H1+△H2=△H3,△H1=+43.5kJmol﹣1,
所以答案是:+43.5kJmol﹣1;(4)水的物质的量为: ![]() =0.3mol,
=0.3mol,
由2H2+O2═2H2O可知,n(H2)=n(H2O)=0.3mol,
由H2(g)+ ![]() O2(g)═H2O(l)△H=﹣285.83kJmol﹣1可知,0.3molH2燃烧放出的热量为:285.83kJ/mol×0.3mol=85.749kJ,
O2(g)═H2O(l)△H=﹣285.83kJmol﹣1可知,0.3molH2燃烧放出的热量为:285.83kJ/mol×0.3mol=85.749kJ,
则CO燃烧放出的热量为:114.03kJ﹣85.749kJ=28.281kJ,
设混合气体中CO的物质的量为x,则
2CO(g)+O2(g)=2CO2(g) | △H=﹣565.8kJmol﹣1 |
2 | 565.8kJ |
x | 28.281kJ |
解得:x=0.1mol,
即原混合气体中CO的物质的量为0.1mol,
所以答案是:0.1mol.
【考点精析】掌握反应热和焓变是解答本题的根本,需要知道在化学反应中放出或吸收的热量,通常叫反应热.

【题目】下列关于胶体的叙述,正确的是( )
A.在饱和氯化铁溶液中逐滴加入NaOH溶液,可制备氢氧化铁胶体
B.明矾净水利用了胶体的吸附性
C.电泳现象可以证明胶体带电
D.胶体粒子很小,可以透过滤纸和半透膜
【题目】人们常常利用化学反应中的能量变化为人类服务。
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大最的热。氢气燃烧生成水蒸气的能最变化如下图所示:
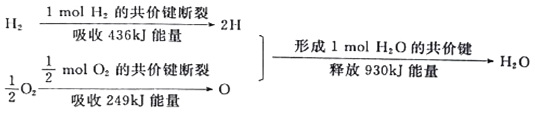
根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着______变化,1molH2完全燃烧生成1molH2O(气态)时,释放的能量是_______kJ。
(2)下列化学反应在理论上可以设计成原电池的是________。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.CH4+2O2![]() CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:
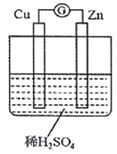
a.电流计指针偏转 |
b.Cu极有H2产生 |
c.H+向负极移动 |
d.电流由Zn经导线流向Cu |
①实验报告中记录合理的是_______(填序号)。
②请写出该电池的负极反应式_________。
③若有1mol电子流过导线,则理论上产生H2的质量为______g.
④将稀H2SO4换成CuSO4溶液,电极质量增加的是______(填“锌极”或“铜极”,下同),溶液中SO42-移向_______。